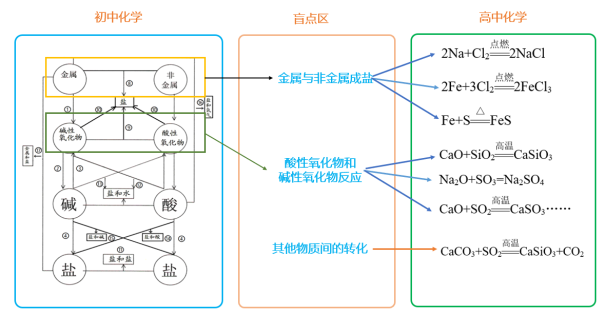
衔接点03 物质的转化

| 初中要求 | 了解常见单质、氧化物、酸碱盐之间的转化。 |
| 高中要求 | 1.理解单质、氧化物、酸碱盐之间的转化规律; 2.了解单质、氧化物、酸碱盐之间的转化的常规转化路径; 3.熟练掌握单质、氧化物、酸碱盐之间的转化方法(十大制盐法) |



1.金属单质的化学性质:
A、金属与氧气的反应
| 金属 | 空气中 | 氧气中 | 反应方程式 |
| 镁(Mg) | 点燃,剧烈燃烧,发出白光,生成白色固体 | 点燃,比在空气中燃烧更剧烈 | 2Mg+O2 2MgO 2MgO |
| 铝(Al) | 常温下,表面生成一层致密的氧化铝薄膜,阻止铝进一步被氧化 | 点燃,剧烈燃烧,发出白光,生成白色固体 | 4Al+3O2=2Al2O3或4Al+3O2 2Al2O3 2Al2O3 |
| 铁(Fe) | 点燃,不燃烧,只发红热 | 点燃,剧烈燃烧、火星四射,生成黑色固体,放出大量的热 | 3Fe+2O2 Fe3O4 Fe3O4 |
| 铜(Cu) | 加热,表面会生成黑色固体 | 2Cu+O2 2CuO 2CuO | |
| 金(Au) | 即使高温条件下,也不与氧气反应 | ||
| 金属 | 与盐酸反应 | 与稀硫酸反应 | 现象 |
| 镁 | Mg+2HCl=MgCl2+H2↑ | Mg+H2SO4=MgSO4+H2↑ | 剧烈反应,产生大量气泡,溶液仍为无色 |
| 铝 | 2Al+6HCl==2AlCl3+3H2↑ | 2Al+3H2SO4=Al2(SO4)3+3H2↑ | 剧烈反应,产生大量气泡,溶液仍为无色 |
| 锌 | Zn+2HCl=ZnCl2+H2↑ | Zn+H2SO4═ZnSO4+H2↑ | 反应比较剧烈,产生气泡,溶液仍为无色 |
| 铁 | Fe+2HCl=FeCl2+H2↑(稀盐酸) | Fe+H2SO4═FeSO4+H2↑ | 反应缓慢,有气泡产生,溶液由无色变为浅绿色 |
| 铜 | 不反应 | ||
(1)铁丝浸入硫酸铜溶液中
Fe +CuSO4 = Cu + FeSO4
应用及说明:
“湿法冶铜”的原理
不能用铁制品放硫酸铜溶液(或农药波尔多液)
现象:铁钉表面有红色物质出现,溶液由蓝色变为浅绿色。
(2)铝丝浸入硫酸铜溶液中
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
现象:铝丝表面有红色物质出现,溶液由蓝色变为无色。
(3)铜丝浸入硝酸银溶液中
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
现象:铜丝表面有银白色物质出现,溶液由无色变为蓝色。
2. 非金属单质的化学性质:
A、与氧气反应
S+O2
 SO2
SO2C+O2
 CO2
CO24P+5O2
 2P2O5
2P2O5……
B、与氧化物的反应
C+2CuO
 2Cu+CO2↑
2Cu+CO2↑2Fe2O3+3C
 4Fe+3CO2↑
4Fe+3CO2↑C+CO2
 2CO
2COH2+CuO
 Cu+H2O
Cu+H2O……
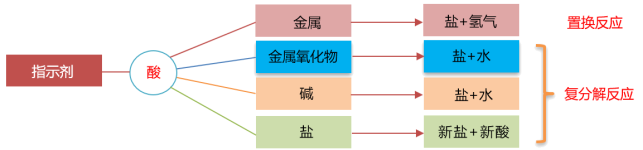
回顾二、常见的酸的化学性质
1.与酸碱指示剂的作用
| 紫色石蕊溶液 | 无色酚酞溶液 | |
| 稀盐酸 | 变红色 | 不变色 |
| 稀硫酸 | 变红色 | 不变色 |
| 与稀盐酸反应的化学方程式 | 与稀硫酸反应的化学方程式 | |
| 镁 | Mg+2HCl=MgCl2+H2↑ | Mg+H2SO4=MgSO4+H2↑ |
| 锌 | Zn+2HCl=ZnCl2+H2↑ | Zn+H2SO4=ZnSO4+H2↑ |
| 铁 | Fe+2HCl=FeCl2+H2↑ | Fe+H2SO4=FeSO4+H2↑ |
| 铝 | 2Al+6HCl=2AlCl3+3H2↑ | 2Al+3H2SO4=Al2(SO4)3+3H2↑ |
| 酸与活泼金属反应的共同现象是:金属逐渐溶解,并产生气泡 | ||
| 现象 | 化学方程式 | |
| 铁锈与稀盐酸 | 铁锈逐渐溶解,溶液由无色变为黄色 | Fe2O3+6HCl=2FeCl3+3H2O |
| 铁锈与稀硫酸 | Fe2O3+3H2SO4=Fe2(SO4)3+3H2O | |
| 氧化铜与稀盐酸 | 黑色粉末逐渐溶解,溶液由无色变为蓝色 | CuO+2HCl=CuCl2+H2O |
| 氧化铜与稀硫酸 | CuO+H2SO4=CuSO4+H2O |
| 现象 | 化学方程式 | |
| 氢氧化钙与稀盐酸 | 滴有酚酞试剂的碱溶液由红色逐渐变成无色,放出热量 | Ca(OH)2+2HCl=CaCl2+2H2O |
| 氢氧化钙与稀硫酸 | Ca(OH)2+H2SO4=CaSO4+2H2O | |
| 氢氧化铜与稀盐酸 | 蓝色固体消失,溶液由无色变为蓝色 | Cu(OH)2+2HCl=CuCl2+2H2O |
| 氢氧化铁与稀硫酸 | 红褐色固体消失,溶液由无色变为黄色 | 2Fe(OH)3+3H2SO4=Fe(SO4)3+3H2O |
| 现象 | 化学方程式 | |
| 碳酸钠与稀盐酸 | 有气泡产生 | Na2CO3+2HCl=2NaCl+CO2↑+H2O |
| 碳酸氢钠与稀硫酸 | 2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O |
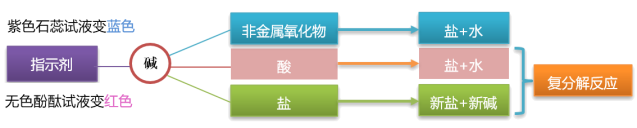
1.与酸碱指示剂反应
| 紫色石蕊溶液 | 无色酚酞溶液 | |
| 氢氧化钠溶液 | 蓝色 | 红色 |
| 氢氧化钙溶液 | 蓝色 | 红色 |
难溶于水的碱不能使酸碱指示剂变色,如氢氧化铜、氢氧化铁、氢氧化镁等。
2.与部分非金属氧化物反应
(1)与二氧化碳的反应
①氢氧化钠:2NaOH+CO2=Na2CO3+H2O
②氢氧化钙:Ca(OH)2+CO2=CaCO3↓+H2O
(2)与二氧化硫的反应
①氢氧化钠:2NaOH+SO2=Na2SO3+H2O
②氢氧化钙:Ca(OH)2+SO2=CaSO3↓+H2O
(3)与三氧化硫的反应
①氢氧化钠:NaOH+SO3=Na2SO4+H2O
②氢氧化钙:Ca(OH)2+SO3=CaSO4↓+H2O
3.与酸反应
①氢氧化钠
NaOH+HCl=NaCl+H2O
2NaOH+H2SO4=Na2SO4+H2O
②氢氧化钙
Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
4.与部分盐反应
①氢氧化钠:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
②氢氧化钙:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
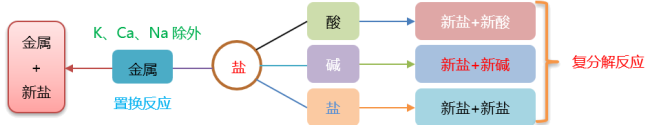
1.盐跟某些金属的反应:
规律:盐+金属=新盐+新金属
反应条件:
在金属活动性顺序表中,除非常活泼的K、Ca和Na外,排在前面的金属一般可以将位于其后面的、比它不活泼的金属从它们的盐溶液中置换出来。
Zn+CuSO4=ZnSO4+Cu;
Cu+HgNO3)2=Hg+Cu(NO3)2;
ZnSO4+Cu不反应
2.盐跟酸的反应:
规律:盐+酸=新盐+新酸
BaCl2+H2SO4=BaSO4+2HCl
AgNO3+HCl=AgCl+HNO3
Na2CO3+2HCl=2NaCl+H2O+CO2↑
3.盐跟碱的反应:
规律:盐+碱=新盐+新碱
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
4.盐跟另一种盐的反应:
规律:盐+盐=新盐+新盐
Na2CO3+CaCl2=CaCO3↓+2NaCl
AgNO3+NaCl=AgCl+NaNO3
BaCl2+Na2SO4=BaSO4+2NaCl

1.基本依据:
化学变化过程中,元素是不会改变的。即化学反应中的质量守恒。
2.应用:
确定制取某类物质的可能方法。
3.实例:
(1)以钙为例,用化学方程式表示钙及其化合物之间的转化关系并指明反应类型。
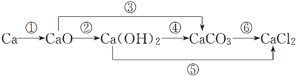
②CaO+H2O=Ca(OH)2,化合反应;
③CaO+CO2=CaCO3,化合反应;
④Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,复分解反应;
⑤Ca(OH)2+2HCl=CaCl2+2H2O,复分解反应;
⑥CaCO3+2HCl=CaCl2+CO2↑+H2O,复分解反应。
(2)碳及其化合物间的转化关系如下图所示:
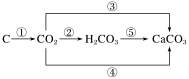
①O2 ②H2O ③Ca(OH)2 ④CaO ⑤Ca(OH)2(答案合理即可)。
(3)单质到盐的一般转化关系:
部分金属单质
 碱性氧化物
碱性氧化物 碱
碱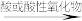 盐
盐如:Na
 Na2O
Na2O NaOH
NaOH Na2SO4
Na2SO4符合上述转化关系的常见金属有Na、K、Ca、Ba等,但Mg、Fe、Al、Cu等不符合上述转化关系。
部分非金属单质
 酸性氧化物
酸性氧化物 酸
酸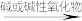 盐
盐如:S
 SO2
SO2 H2SO3
H2SO3 Na2SO3
Na2SO3符合上述转化关系的常见非金属有C、S、P等,但N、Si等不符合上述转化关系。
4.工业生产中的其他因素:
①最适当方法的选择
a.一般不采用Na2O与H2O反应的原因:Na2O作为原料,来源少、成本高;
b.主要采用方法:电解饱和食盐水;
c.过去曾采用方法:盐(如Na2CO3)与碱[如Ca(OH)2]反应。
新知二、单质、氧化物、酸、碱、盐之间的转化关系
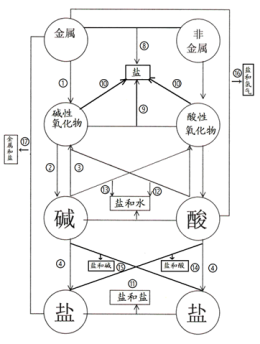
两条纵线通到底(七条规律)(1)~(7)
四条横线相联系(四条规律)(8)~(11)
六条交叉成网络(六条规律)(12)~(17)
十七规律须牢记
纵向:
(1)金属+O2
 金属氧化物(碱性氧化物)
金属氧化物(碱性氧化物) 4Na+ O2=2Na2O 2Cu+ O2=2CuO
(2)碱性氧化物(可溶)+水→碱(可溶)
Na2O+H2O=2NaOH
(3)碱(难溶)
 碱性氧化物(难溶) + 水
碱性氧化物(难溶) + 水 Cu(OH)2
 CuO+H2O
CuO+H2O(4)酸+碱→盐+水
3NaOH+H3PO4=Na3PO4+3H2O
Cu(OH)2+H2SO4=CuSO4+2H2O
(5)非金属+ O2
 非金属氧化物(酸性氧化物)
非金属氧化物(酸性氧化物)C+O2
 CO2
CO2S+O2
 SO2
SO24P+5O2
 2P2O5
2P2O5(6)酸性氧化物(易溶)+水→酸(易溶)
CO2+H2O=H2CO3
P2O5+3H2O=2H3PO4
(7)酸(易挥发/难溶)→酸酐+水(易挥发/难溶)
H2CO3 = CO2↑+H2O
H2SiO3
 H2O+SiO2
H2O+SiO2 从纵向来看,金属→碱性氧化物→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:
(8)金属+非金属→(无氧酸)盐
2Na+Cl2
 2NaCl
2NaCl (9)碱性氧化物+酸性氧化物→(含氧酸)盐
Na2O+CO2=Na2CO3
(10)含氧酸盐→碱性氧化物+酸性氧化物
CaCO3
 CaO+ CO2↑
CaO+ CO2↑(11)盐+盐→两种新盐
NaCl+AgNO3=NaNO3+AgCl↓
交叉:
(12)酸+碱性氧化物→盐+水
H2SO4+CuO=CuSO4+H2O
(13)碱+酸性氧化物→盐+水
2NaOH+CO2=Na2CO3+H2O
(14)酸+盐→新酸+新盐
Na2CO3+ H2SO4= Na2SO4 +H2CO3
H2CO3 = CO2↑+H2O
(15)碱+盐
 新碱+新盐
新碱+新盐 2NaOH+ CuSO4= Na2SO4+Cu(OH)2↓
(16)金属+酸→盐+H2↑
Zn+H2SO4=ZnSO4+H2↑
(17)金属+盐
 新盐+新金属
新盐+新金属 Zn+H2SO4=ZnSO4+H2↑
Zn+CuSO4=ZnSO4+Cu
以上十七条规律的应用:
(1)可预知某物质的性质。
(2)可知某物质的制法。如:(4)、(8)、(9)、(11)~(17)为盐的十种制法。
(3)已知各类物质间的相互关系。
说明:
<1>以上各规律为各物质间相互转化的一般规律,具体到某些物质有些规律要具体分析,未必均适用。
例如:制取ZnCl2的方法与制取CuSO4的方法各有几种?(思考)
<2>此外,在物质的制取中还有一些常见的规律,如:
对于盐+酸→新盐+新酸,有如下规律:
①强酸→弱酸
如:CaCO3+2HCl=CaCl2+H2O+CO2↑
②稳定的(不易分解的)酸
 不稳定的(另分解的)酸。
不稳定的(另分解的)酸。CaCO3+2HCl=CaCl2+H2O+CO2↑
③高沸点(不易挥发的)酸
 低沸点(易挥发的)酸。
低沸点(易挥发的)酸。如:H2SO4(浓)+2NaCl
 Na2SO4+2HCl↑
Na2SO4+2HCl↑④可溶性酸
 难溶性酸。
难溶性酸。如:Na2SiO3+2HCl=H2SiO3↓+2NaCl
<3> 从反应规律与反应类型的关系来看。
属于化合反应的有:规律(1)、(2)、(5)、(6)、(8)、(9)。
属于分解反应的有:规律(3)、(7)、(10)。
属于置换反应的有:规律(16)、(17)。
属于复分解反应的有:规律(4)、(11)、(12)、(14)、(15)。
规律(13)不属于任何一种基本反应类型。
初中阶段不属于任何一种基本反应类型的反应包括:
CH4+2O2
 CO2+2H2O
CO2+2H2OC2H5OH+3O2
 2CO2+3H2O
2CO2+3H2OCO+CuO
 Cu+CO2
Cu+CO2新知三、化学反应的类型


(重庆市2023学年高一上学期期末)
(甘肃省酒泉市2023学年高一上学期期末)
(安徽省淮北市实验高级中学2023学年高一上学期期末)
(山东省聊城市2023学年高一上学期期末)

(2023春·天津·高一统考期中)
(2023春·江苏淮安·高一校联考期中)
(2023年河南省郑州市中牟县期中)
(2023年江苏省扬州中学期中)
(2023年山西省长治市第一中学校高一期末)
(2023河北省承德市双滦区实验中学期中)
(2023北京西域期末)
(2023江西宜春高二上高二中校考阶段练习)
(2023福建漳州正兴学校期中)
(2023年贵州毕节)
(2022秋·福建省南平市高级中学校考期中)

打开组卷App 获取专属积分,充值下载直接抵现

