科学探究题 较难0.4 引用1 组卷135
酸和碱作用生成盐和水的反应叫中和反应。某化学兴趣小组同学对“盐酸 中和氢氧化钠溶液”的反应进行探究。
(1)小明在做“盐酸中和氢氧化钠溶液”的实验时,测出反应过程中溶液的 pH 变化如图所示。
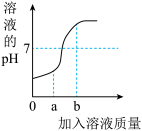
①该反应的化学方程式为:___________ 。
②该实验操作是将_________ 滴加到另一种溶液中。
③当加入溶液的质量为 ag 时,所得溶液中的阳离子有(写符号)_____________ 。
④当加入溶液的质量为 bg 时,向所得溶液溶液中滴入紫色石蕊试液,紫色石蕊试液变________ 色。
(2)小亮在做“盐酸中和氢氧化钠溶液”的实验时,向氢氧化 钠溶液里滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度,于是他 对所得溶液的酸碱性进行探究。
(探究目的)探究所得溶液的酸碱性。
(提出猜想)所得溶液可能呈酸性,也可能呈___________ 性,还可能呈碱性。
(实验验证)
(交流与反思)
①若溶液呈碱性,则溶液中使其呈碱性的离子是__________ (写符号)。
②若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:取样,加入_____________ ,若有______________ 现象,则呈酸性;若无明显现象,则呈中性。
(1)小明在做“盐酸中和氢氧化钠溶液”的实验时,测出反应过程中溶液的 pH 变化如图所示。

①该反应的化学方程式为:
②该实验操作是将
③当加入溶液的质量为 ag 时,所得溶液中的阳离子有(写符号)
④当加入溶液的质量为 bg 时,向所得溶液溶液中滴入紫色石蕊试液,紫色石蕊试液变
(2)小亮在做“盐酸中和氢氧化钠溶液”的实验时,向氢氧化 钠溶液里滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度,于是他 对所得溶液的酸碱性进行探究。
(探究目的)探究所得溶液的酸碱性。
(提出猜想)所得溶液可能呈酸性,也可能呈
(实验验证)
| 实验操作 | 实验现象 | 结论 |
| 用试管取该溶液 1-2mL,滴入 1-2滴无色酚酞试液,振荡。 | 无色酚酞试液变 | 溶液呈碱性 |
| 无色酚酞试液不变色 | 溶液呈 |
①若溶液呈碱性,则溶液中使其呈碱性的离子是
②若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:取样,加入
2020九年级下·天津滨海新·学业考试
类题推荐
我国西汉时期就有“曾青得铁则化为铜”的记载。现阶段,这种方法在生产有色金属方面的作用越来越大。化学兴趣小组的同学们对炼铜原料、炼铜的原理、炼铜厂废水的成分、炼铜业的发展前景等产生兴趣,开启了项目化学习之旅。
任务一:了解炼铜所用原料【查阅资料】炼铜的原料主要是铜矿石。铜矿石可分为三类(括号内为主要成分):(1)硫化矿,如黄铜矿(CuFeS2)、斑铜矿(Cu5FeS4)和辉铜矿(Cu2S)等;(2)氧化矿,如赤铜矿(Cu2O),孔雀石【Cu2(OH)2CO3】等;(3)自然铜。铜矿石中铜的含量在1%左右(0.5%~3%)的便有开采价值。
【分析资料】
(1)同学们分析资料信息后,认为主要成分属于氧化物的铜矿石为______ 。
任务二:咨询专家炼铜的原理
创新小组的同学们线上咨询了炼铜厂的专家,了解到铜的冶炼有两种方法,一种是火法炼铜,另一种是湿法炼铜。
【交流讨论】
(2)火法炼铜的主要原理是在高温下硫化亚铜与氧气作用生成铜和二氧化硫气体。该反应属于______ (填基本反应类型)。
(3)与湿法炼铜相比,火法炼铜具有_______ (写1条)的缺点。
任务三:探究湿法炼铜厂废水的成分
【教师指导】湿法炼铜厂废水中可能含有酸性物质。
【猜想假设】炼铜厂废水中可能含有硫酸和硫酸铜。
【进行实验】设计实验方案,探究废水成分。
(4)请完善下面表格。
【总结反思】
(5)步骤③中发生反应的化学方程式为______ (写一个)。
(6)小智认为步骤①②可以并为一步,只用一种试剂即可,该试剂可能是________ 。
任务四:展望炼铜业发展前景
(7)随着世界经济的绿色循环发展,对废铜进行回收、冶炼、加工、再利用将成为我国循环经济发展中不可缺少的组成部分。这样做的意义是________ 。
任务一:了解炼铜所用原料【查阅资料】炼铜的原料主要是铜矿石。铜矿石可分为三类(括号内为主要成分):(1)硫化矿,如黄铜矿(CuFeS2)、斑铜矿(Cu5FeS4)和辉铜矿(Cu2S)等;(2)氧化矿,如赤铜矿(Cu2O),孔雀石【Cu2(OH)2CO3】等;(3)自然铜。铜矿石中铜的含量在1%左右(0.5%~3%)的便有开采价值。
【分析资料】
(1)同学们分析资料信息后,认为主要成分属于氧化物的铜矿石为
任务二:咨询专家炼铜的原理
创新小组的同学们线上咨询了炼铜厂的专家,了解到铜的冶炼有两种方法,一种是火法炼铜,另一种是湿法炼铜。
【交流讨论】
(2)火法炼铜的主要原理是在高温下硫化亚铜与氧气作用生成铜和二氧化硫气体。该反应属于
(3)与湿法炼铜相比,火法炼铜具有
任务三:探究湿法炼铜厂废水的成分
【教师指导】湿法炼铜厂废水中可能含有酸性物质。
【猜想假设】炼铜厂废水中可能含有硫酸和硫酸铜。
【进行实验】设计实验方案,探究废水成分。
(4)请完善下面表格。
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量湿法炼铜厂废水于试管中,滴入几滴紫色石蕊溶液 | 废水中含有硫酸和硫酸铜 | |
| ②另取少量湿法炼铜厂废水于试管中,加入足量 | 产生蓝色沉淀 | |
| ③另取少量湿法炼铜厂废水于试管中,滴加过量Ba(NO3)2溶液 | 产生白色沉淀 |
【总结反思】
(5)步骤③中发生反应的化学方程式为
(6)小智认为步骤①②可以并为一步,只用一种试剂即可,该试剂可能是
任务四:展望炼铜业发展前景
(7)随着世界经济的绿色循环发展,对废铜进行回收、冶炼、加工、再利用将成为我国循环经济发展中不可缺少的组成部分。这样做的意义是
铁及其化合物在生活生产中应用非常广泛。某兴趣小组的同学对于碳酸亚铁的制取和相关性质进行探究。
【查阅资料】
①溶液pH大于8.8时,Fe2+可完全转化为Fe(OH)2沉淀。
②FeCO3是白色固体,难溶于水,遇氧气和水会发生反应,生成Fe(OH)3,遇酸也会发生反应。
③FeCl3溶液中滴加KSCN溶液,溶液会变为血红色;而FeCl2溶液中滴加KSCN溶液,溶液不变色。
④碱石灰(NaOH和CaO的混合物),可吸收CO2气体。
【进行实验】
(1)制取FeCO3
①兴趣小组的同学将已生锈的铁钉放入稀硫酸中除锈,该反应的化学方程式为______ 。
②将除尽铁锈后的铁钉再放入是量的稀硫酸中,反应完成后发现溶液中有少量黑色固体出现,说明除锈后的铁钉属于______ (填“纯金属"或“合金”)。
③用FeSO4溶液和pH=11.9的Na2CO3溶液反应制取FeCO3时,可能制得FeCO3的操作是______ (填字母)。
A.将少量的FeSO4溶液与大量的Na2CO3溶液同时加入到烧杯中,边加边搅拌溶液,边加边搅拌
B.先将Na2CO3溶液加入烧杯中,再缓慢加入FeSO4溶液边加边搅拌
C.先将FeSO4溶液加入烧杯中,再缓慢加入Na2CO3溶液,边加边搅拌
(2)探究久置于潮湿空气中FeCO3的成分。
实验Ⅰ:
实验Ⅱ:
该兴趣小组为进一步确定固体中FeCO3的质量分数,称取一定量的固体做了如图所示的实验。______ (填字母);装置 C中盛放的溶液是______ (填字母),装置C的目的是______ 。
A.浓盐酸 B.稀硫酸 C.氢氧化钠溶液 D.氯化钙溶液
②反应结束后,继续通入一段时间N2的目的是______ 。
③实验结束后,测得装置C和D增重的质量,可计算出图体中FeCO3的质量分数。
【实验结论】碳酸亚铁在潮湿的空气中易变质,故需要______ 保存。
【查阅资料】
①溶液pH大于8.8时,Fe2+可完全转化为Fe(OH)2沉淀。
②FeCO3是白色固体,难溶于水,遇氧气和水会发生反应,生成Fe(OH)3,遇酸也会发生反应。
③FeCl3溶液中滴加KSCN溶液,溶液会变为血红色;而FeCl2溶液中滴加KSCN溶液,溶液不变色。
④碱石灰(NaOH和CaO的混合物),可吸收CO2气体。
【进行实验】
(1)制取FeCO3
①兴趣小组的同学将已生锈的铁钉放入稀硫酸中除锈,该反应的化学方程式为
②将除尽铁锈后的铁钉再放入是量的稀硫酸中,反应完成后发现溶液中有少量黑色固体出现,说明除锈后的铁钉属于
③用FeSO4溶液和pH=11.9的Na2CO3溶液反应制取FeCO3时,可能制得FeCO3的操作是
A.将少量的FeSO4溶液与大量的Na2CO3溶液同时加入到烧杯中,边加边搅拌溶液,边加边搅拌
B.先将Na2CO3溶液加入烧杯中,再缓慢加入FeSO4溶液边加边搅拌
C.先将FeSO4溶液加入烧杯中,再缓慢加入Na2CO3溶液,边加边搅拌
(2)探究久置于潮湿空气中FeCO3的成分。
实验Ⅰ:
| 实验操作 | 实验现象 | 结论 |
| ①取少量久置于潮湿空气中的FeCO3固体于试管中,加入足量的稀盐酸 | 观察到试管内 | 说明该固体中含有FeCO3 |
| ②取少量上述反应后的溶液于试管中,滴加 | 可观察到 | 说明久置于空气中的FeCO3固体中还含有Fe(OH)3 |
该兴趣小组为进一步确定固体中FeCO3的质量分数,称取一定量的固体做了如图所示的实验。

A.浓盐酸 B.稀硫酸 C.氢氧化钠溶液 D.氯化钙溶液
②反应结束后,继续通入一段时间N2的目的是
③实验结束后,测得装置C和D增重的质量,可计算出图体中FeCO3的质量分数。
【实验结论】碳酸亚铁在潮湿的空气中易变质,故需要
某白色固体可能由BaCl2、NaOH、Na2CO3、Na2SO4、CuO中的一种或几种物质组成。同学们为了确定该白色固体的成分,进行如下实验探究:
【资料卡片】溶液显中性。
【初步结论】(1)甲同学根据固体的描述确定样品中肯定没有___________ (填化学式),原因是_________ 。
【初步探究】同学们设计的实验过程及现象如图所示。
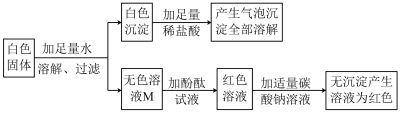
【交流讨论】(2)同学们认为:无色溶液M中一定含有___________ (填化学式),无色溶液M加入酚酞试液后变红色,说明溶液M显___________ 性,需对溶液M继续探究。
【提出问题】无色溶液M中除一定含有的物质和水外还含有什么物质?
【猜想与假设】猜想一:NaOH;猜想二:Na2CO3;猜想三:(3)___________ 。
【探究与结论】乙、丙同学先后进行了实验:
(5)乙同学的操作过程发生反应的化学方程式为_________ 。
(6)乙同学加入过量氯化钡溶液的作用:①____________ ,②__________ 。
【实验结论】(7)原白色固体中一定含有的物质是___________ (填化学式)。
【资料卡片】溶液显中性。
【初步结论】(1)甲同学根据固体的描述确定样品中肯定没有
【初步探究】同学们设计的实验过程及现象如图所示。

【交流讨论】(2)同学们认为:无色溶液M中一定含有
【提出问题】无色溶液M中除一定含有的物质和水外还含有什么物质?
【猜想与假设】猜想一:NaOH;猜想二:Na2CO3;猜想三:(3)
【探究与结论】乙、丙同学先后进行了实验:
实验步骤 | 实验现象 | 实验结论 | |
| 乙同学 | 取无色溶液M于试管中,加入过量的氯化钡溶液,振荡、静置 | (4) | 猜想二成立 |
| 丙同学 | 取乙同学实验所得上层清液少许于试管中,加入酚酞试液 | 溶液变红色 | 猜想三成立 |
(6)乙同学加入过量氯化钡溶液的作用:①
【实验结论】(7)原白色固体中一定含有的物质是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


