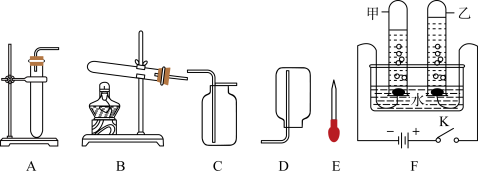综合应用题 较难0.4 引用1 组卷105
人类文明的发展和社会的进步同金属材料关系十分密切。
(一)铁的应用及防护
(1)生活中常用铁锅烹饪,主要利用铁的_____ (填字母)。
a 导电性 b 导热性 c 耐腐蚀
(2)“发蓝“处理是在铁表面形成致密氧化膜,以防止其腐蚀。“发蓝”的原理是:36Fe + 4NaNO2 + 9NaNO3 + 26H2O=12X + 13NaOH + 13NH3↑,X的化学式为_____
(3)患贫血症的人体内需要补铁____ (填字母)。
a 分子 b 原子 c 元素
(4)如图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是____ (选填序号)。

(5)铁生锈的主要过程为:
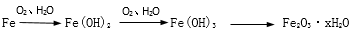
写出Fe(OH)2→Fe(OH)3反应的化学方程式______ 。
(二)铁的冶炼和探究
取20.0g Fe2O3粉末,小组同学用下图装置模拟炼铁,并测定反应后固体成分。
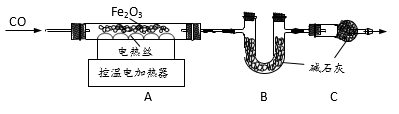
资料:碱石灰可吸收H2O和CO2。
(1)连接装置,先____ ,再装入药品。
(2)实验时先通入CO,目的是___ 。
(3)该实验装置有一个明显缺陷,你认为是___ 。
(4)控制A中温度在700℃至固体全部 变黑,继续通CO至冷却。
①通过测定装置B中固体的质量变化,可准确求得装置A中剩余固体质量。装置C的作用是____ 。
②现直接测得装置A中剩余固体质量为17.2g。则装置B中固体应增重___ g。
(5)经分析A中剩余固体17.2g为Fe和FexOy的混合物,向其中加入足量的稀H2SO4,充分反应,得H2 质量为0.1g。(FexOy和稀H2SO4反应,但无气体产生)
①固体中Fe质量为______ g。 ②FexOy的化学式为____ 。
(三)成分探究
【查阅资料】用CO还原Fe2O3炼铁的过程大致分为三个阶段:
阶段1:3Fe2O3+CO 2Fe3O4+CO2
2Fe3O4+CO2
阶段2:Fe3O4+CO 3FeO+CO2
3FeO+CO2
阶段3:FeO+CO Fe+CO2
Fe+CO2
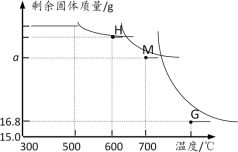
另取一定量Fe2O3进行上述实验,加热时固体质量随温度变化的曲线如图所示.回答下列问题:
(1)温度控制在300℃—500℃范围时,固体质量没有发生变化,原因是____ 。
(2)图中H点对应的固体成分的化学式是____
(3)图中M点对应a的数值=___
(一)铁的应用及防护
(1)生活中常用铁锅烹饪,主要利用铁的
a 导电性 b 导热性 c 耐腐蚀
(2)“发蓝“处理是在铁表面形成致密氧化膜,以防止其腐蚀。“发蓝”的原理是:36Fe + 4NaNO2 + 9NaNO3 + 26H2O=12X + 13NaOH + 13NH3↑,X的化学式为
(3)患贫血症的人体内需要补铁
a 分子 b 原子 c 元素
(4)如图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是

(5)铁生锈的主要过程为:
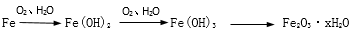
写出Fe(OH)2→Fe(OH)3反应的化学方程式
(二)铁的冶炼和探究
取20.0g Fe2O3粉末,小组同学用下图装置模拟炼铁,并测定反应后固体成分。

资料:碱石灰可吸收H2O和CO2。
(1)连接装置,先
(2)实验时先通入CO,目的是
(3)该实验装置有一个明显缺陷,你认为是
(4)控制A中温度在700℃至固体
①通过测定装置B中固体的质量变化,可准确求得装置A中剩余固体质量。装置C的作用是
②现直接测得装置A中剩余固体质量为17.2g。则装置B中固体应增重
(5)经分析A中剩余固体17.2g为Fe和FexOy的混合物,向其中加入足量的稀H2SO4,充分反应,得H2 质量为0.1g。(FexOy和稀H2SO4反应,但无气体产生)
①固体中Fe质量为
(三)成分探究
【查阅资料】用CO还原Fe2O3炼铁的过程大致分为三个阶段:

阶段1:3Fe2O3+CO
阶段2:Fe3O4+CO
阶段3:FeO+CO
另取一定量Fe2O3进行上述实验,加热时固体质量随温度变化的曲线如图所示.回答下列问题:
(1)温度控制在300℃—500℃范围时,固体质量没有发生变化,原因是
(2)图中H点对应的固体成分的化学式是
(3)图中M点对应a的数值=
19-20九年级上·江苏镇江·阶段练习
类题推荐
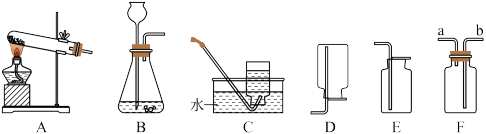
某兴趣小组通过以下实验探究气体的制取方法和性质。已知:白色的无水硫酸铜粉末与水反应生成蓝色的硫酸铜晶体,小华同学用设计的实验装置(如下图 1)来制取气体。
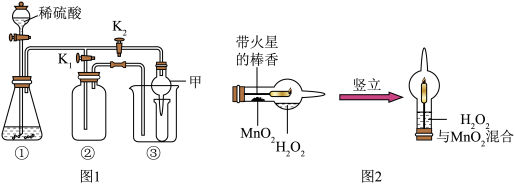
(1)装置①中添加液体的仪器名称_____ 。当打开 K1、关闭 K2时,利用①、②装置可直接进行的实验是_____ (填字母)。
A. 过氧化氢溶液和二氧化锰混合制取氧气 B. 锌与稀硫酸反应制取氢气
(2)利用①、②装置中制得的气体不纯,小明同学认为杂质可能为水蒸气,这是科学探究中的 (填字母)。
(3)打开 K2、关闭 K1,利用①、③装置来验证产生的气体中含水蒸气,此时仪器甲中盛放的物质是_____ ,可以观察到的现象是_____ 。
(4)图 2 仪器具有多种用途,小亮同学利用它制氧气并验证氧气性质:图2装置内发生的反应方程式____ 。实验过程中观察到的现象为_____ 。
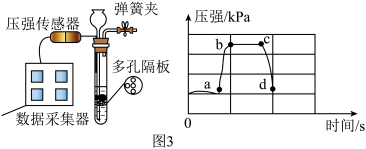
(5)兴趣小组在实验室制取二氧化碳气体的发生装置中连接上压强传感器,测得实验过程中试管内气体压强变化情况如图3,由此可知,石灰石与盐酸脱离接触的是 (填选项)。
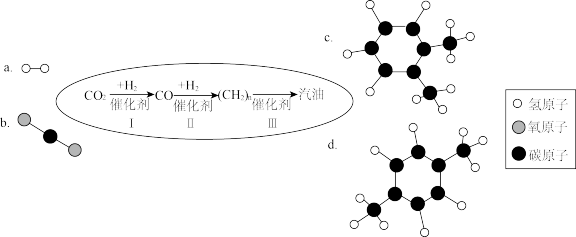
(6)以CO2为碳源,与H2经催化可转化为高附加值的有机物,此方法具有重要的战略意义。中国化学家使用特殊的催化剂实现了CO2和H2转化为A或B等有机物和水,反应原理如图4所示:请回答下列问题:
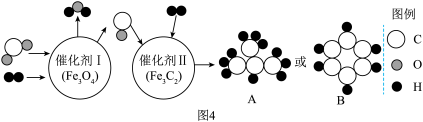
①A的化学式是_____ 。
②根据催化剂的特性可知,催化剂在该反应前后的质量和_____ 不变。
③理论上讲,当原料气中碳、氢元素质量比为_____ ,最终产物是B。

(1)装置①中添加液体的仪器名称
A. 过氧化氢溶液和二氧化锰混合制取氧气 B. 锌与稀硫酸反应制取氢气
(2)利用①、②装置中制得的气体不纯,小明同学认为杂质可能为水蒸气,这是科学探究中的 (填字母)。
| A.提出问题 | B.做出假设 | C.进行实验 | D.获得结论 |
(4)图 2 仪器具有多种用途,小亮同学利用它制氧气并验证氧气性质:图2装置内发生的反应方程式
(5)兴趣小组在实验室制取二氧化碳气体的发生装置中连接上压强传感器,测得实验过程中试管内气体压强变化情况如图3,由此可知,石灰石与盐酸脱离接触的是 (填选项)。
| A.ab 段 | B.bc 段 | C.cd 段 |

(6)以CO2为碳源,与H2经催化可转化为高附加值的有机物,此方法具有重要的战略意义。中国化学家使用特殊的催化剂实现了CO2和H2转化为A或B等有机物和水,反应原理如图4所示:请回答下列问题:

①A的化学式是
②根据催化剂的特性可知,催化剂在该反应前后的质量和
③理论上讲,当原料气中碳、氢元素质量比为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网