实验题 0.4 引用2 组卷224
化学老师指导某化学兴趣学习小组进行了一个有趣的实验探究:测定鸡蛋壳的主要成分碳酸钙的质量分数(假设杂质不溶于水、也不跟盐酸反应)。实验方案如下:
(1)方案一:将鸡蛋壳洗净、干燥并捣碎后,称取10.00g放在烧杯里,然后往烧杯中加入足量的稀盐酸50mL(密度1.10g/mL),充分反应后,取反应剩余固体洗净、干燥后称量为0.50g。
①上述稀盐酸的质量为__________ g,产生二氧化碳气体的质量为__________ g。
②该鸡蛋壳中碳酸钙的质量分数为__________ 。
③该稀盐酸中 的质量分数应不小于
的质量分数应不小于__________ 。
(2)方案二:将10.00g样品与足量稀盐酸反应,测定反应后生成 的体积,再根据体积换算为质量,最后根据
的体积,再根据体积换算为质量,最后根据 的质量求出样品中碳酸钙的质量。图I为样品与稀盐酸反应的反应装置,图Ⅱ用于测量
的质量求出样品中碳酸钙的质量。图I为样品与稀盐酸反应的反应装置,图Ⅱ用于测量 的体积。
的体积。
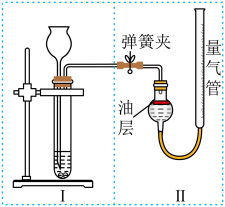
①图Ⅱ中油层的作用是____________________ 。测定反应后生成 的体积是否需要预先排除装置内的空气?
的体积是否需要预先排除装置内的空气?__________ 。
②采用__________________________________________________ (填操作方法),可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积。
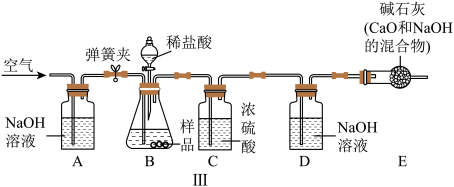
(3)方案三装置如图Ⅲ所示。操作步骤有:①检查装置的气密性;②称量装置D的质量为 g;③称量
g;③称量 g样品装入B中;④关闭止水夹;⑤缓慢加入稀盐酸至不再产生气体为止;⑥打开止水夹;⑦缓缓通入空气数分钟,再称量装置D的质量为
g样品装入B中;④关闭止水夹;⑤缓慢加入稀盐酸至不再产生气体为止;⑥打开止水夹;⑦缓缓通入空气数分钟,再称量装置D的质量为 g。
g。
根据方案三的数据,算出样品中碳酸钙的质量分数为___________ (用代数式表示)。图中装置C的作用是吸收 中的水蒸气,装置A的作用是
中的水蒸气,装置A的作用是__________________ 。步骤⑦的作用是________________________________________________ 。若没有装置E,导致测量结果__________ (填“偏大”“偏小”或“无影响”)。
(4)反思交流查阅资料得知鸡蛋壳中还含有少量碳酸镁、磷酸钙及磷酸镁,碳酸盐都能与醋酸反应生成 ,磷酸钙及磷酸镁都难溶于稀醋酸及水。根据这些信息,若要采用上述方案三精确测定碳酸钙的含量,则需要将稀盐酸改为
,磷酸钙及磷酸镁都难溶于稀醋酸及水。根据这些信息,若要采用上述方案三精确测定碳酸钙的含量,则需要将稀盐酸改为___________ ;若要测定样品中碳酸钙和碳酸镁的总质量,则需要增补的操作步骤是____________________________________________ 。
(1)方案一:将鸡蛋壳洗净、干燥并捣碎后,称取10.00g放在烧杯里,然后往烧杯中加入足量的稀盐酸50mL(密度1.10g/mL),充分反应后,取反应剩余固体洗净、干燥后称量为0.50g。
①上述稀盐酸的质量为
②该鸡蛋壳中碳酸钙的质量分数为
③该稀盐酸中
(2)方案二:将10.00g样品与足量稀盐酸反应,测定反应后生成


①图Ⅱ中油层的作用是
②采用
(3)方案三装置如图Ⅲ所示。操作步骤有:①检查装置的气密性;②称量装置D的质量为
根据方案三的数据,算出样品中碳酸钙的质量分数为
(4)反思交流查阅资料得知鸡蛋壳中还含有少量碳酸镁、磷酸钙及磷酸镁,碳酸盐都能与醋酸反应生成
2019九年级·全国·专题练习


