科学探究题 较难0.4 引用1 组卷81
过氧化钠是化学中常见的一种药品,它是浅黄白色颗粒粉末。在空气中吸收水分和二氧化碳。易溶于水,与水中能发生反应生成氢氧化钠和过氧化氢,方程式:Na2O2+2H2O=2NaOH+H2O2,过氧化氢又能分解放出氧气。
(1)区分水和过氧化氢的实验方法是:_____ ;发生的反应方程式是:_____ 。
(2)某同学为了证明过氧化钠加入水中生成了氢氧化钠,在生成的溶液中滴加了几滴无色酚酞试液,观察到的现象是溶液先变红后褪为无色 ,请你对此现象进行探究。
【提出问题】:什么导致溶液先变红再褪色?
【猜想与假设】:猜想1:甲同学“可能是无色酚酞溶液变质导致溶液褪色”;
猜想2:乙同学“可能是生成的过氧化氢使溶液褪色”。
【实验与结论】:a:甲同学提出的猜想,立即遭到其他同学的反对,因为_____ ;
b:为了验证自己的猜想,乙同学设计了以下方案并实验验证:
【讨论交流】:你还能提出不同的猜想吗?
猜想3:_____ 。
方案3:
(1)区分水和过氧化氢的实验方法是:
(2)某同学为了证明过氧化钠加入水中生成了氢氧化钠,在生成的溶液中滴加了几滴无色酚酞试液,观察到的现象是溶液
【提出问题】:什么导致溶液先变红再褪色?
【猜想与假设】:猜想1:甲同学“可能是无色酚酞溶液变质导致溶液褪色”;
猜想2:乙同学“可能是生成的过氧化氢使溶液褪色”。
【实验与结论】:a:甲同学提出的猜想,立即遭到其他同学的反对,因为
b:为了验证自己的猜想,乙同学设计了以下方案并实验验证:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量稀氢氧化钠溶液于试管中,滴加1—2滴酚酞试液,变红后 | 溶液依然为 |
猜想3:
方案3:
| 实验步骤 | 实验现象 | 实验结论 |
2019·安徽淮南·一模
类题推荐
小李进行以下三组实验探究
【第一组实验】
将实验剩余的 FeCl3溶液倒入含有 H2O2的废液缸,立即产生大量的无色气泡。
①小李根据组成的元素猜测,无色气体可能是 H2、O2、HCl、Cl2中的一种或多种。
②FeCl3在水中电解出Fe 3+、Cl-。
【查阅资料】
Cl2是黄绿色、有刺激性气味的气体,根据资料,小李可排除的气体为_____ 。
(实验一)
为进一步验证该气体成分,他用燃着的木条伸入收集满该气体的小试管中,只观察到木条燃得更旺,则该气体一定含_____ 。
小李认为上述过程中 FeCl3溶液作了 H2O2分解的催化剂。
(实验二)
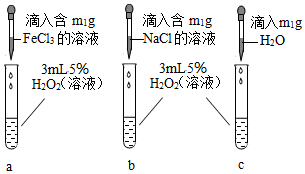
为进一步探究哪种离子起催化作用,他做了如图所示的对比实验。若要证明 FeCl3溶液中的Fe 3+对 H2O2分解起催化作用,除观察到试管 c 中无明显现象外,还需观察到的现象为_____ 。
【第二组实验】
小李在某次电解水的实验中测得了分别与电源负、正两极相连的阴、阳两极上产生的气体的实验数据如下:
仔细分析以上实验数据,1-6min 内阴、阳两极生成的气体体积之比大于 2:1,可能的原因中_____ ,从第 7 分钟开始,每分钟内阴、阳两极生成的气体体积之比约为 2:1,可能的原因是_____ 。
【第三组实验】
实验室制取氧气通常不用电解水的方法,而是采用以下方法:
①用氯酸钾和二氧化锰的混合物来制取氧气时,反应的符号表达式是_____ 。
②用制取的氧气做铁丝燃烧的实验,反应的符号表达式是_____ 。
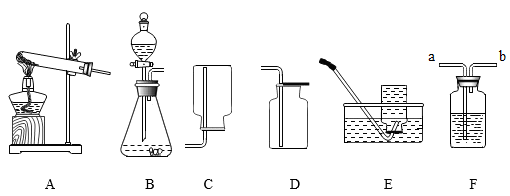
③实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。甲烷的密度比空气小,不溶于水。制取甲烷的发生装置和收集干燥的甲烷可选用_____ (填字母)。
【第一组实验】
将实验剩余的 FeCl3溶液倒入含有 H2O2的废液缸,立即产生大量的无色气泡。
①小李根据组成的元素猜测,无色气体可能是 H2、O2、HCl、Cl2中的一种或多种。
②FeCl3在水中电解出Fe 3+、Cl-。
【查阅资料】
Cl2是黄绿色、有刺激性气味的气体,根据资料,小李可排除的气体为
(实验一)
为进一步验证该气体成分,他用燃着的木条伸入收集满该气体的小试管中,只观察到木条燃得更旺,则该气体一定含
小李认为上述过程中 FeCl3溶液作了 H2O2分解的催化剂。
(实验二)
为进一步探究哪种离子起催化作用,他做了如图所示的对比实验。若要证明 FeCl3溶液中的Fe 3+对 H2O2分解起催化作用,除观察到试管 c 中无明显现象外,还需观察到的现象为

【第二组实验】
小李在某次电解水的实验中测得了分别与电源负、正两极相连的阴、阳两极上产生的气体的实验数据如下:
| 时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体体积/cm 3 | 6 | 12 | 20 | 29 | 39 | 49 | 55 | 65 | 75 | 85 |
| 阳极生成气体体积/cm 3 | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,1-6min 内阴、阳两极生成的气体体积之比大于 2:1,可能的原因中
【第三组实验】
实验室制取氧气通常不用电解水的方法,而是采用以下方法:

①用氯酸钾和二氧化锰的混合物来制取氧气时,反应的符号表达式是
②用制取的氧气做铁丝燃烧的实验,反应的符号表达式是
③实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。甲烷的密度比空气小,不溶于水。制取甲烷的发生装置和收集干燥的甲烷可选用
人教版新课标化学九年级上册教材中“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【提出问题】氧化铁(Fe2O3)能否作过氧化氢溶液分解的催化剂?如果能,其效果如何?
【实验结论】(1)实验Ⅱ、Ⅲ证明:氧化铁的_____ 和_____ 在反应前后均没有发生变化,可以作过氧化氢分解的催化剂。
(2)写出氧化铁催化过氧化氢分解的符号表达式:_____ 。
【实验评价】(3)设计实验Ⅳ的目的是____ 。
(4)若实验Ⅳ观察到D试管中产生气泡的速率更快,由此可以得到的结论是_____ 。
(5)还有哪些因素可能影响该反应的速率呢?请说出你的一个猜想:_____
(6)请设计实验证明你的猜想(实验包括步骤、现象、结论):______ 。
【提出问题】氧化铁(Fe2O3)能否作过氧化氢溶液分解的催化剂?如果能,其效果如何?
| 实验步骤 | 实验现象 |
| Ⅰ.分别量取5 mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星的木条,观察现象 | A试管中产生气泡,带火星的木条复燃,B试管中无明显现象 |
| Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次实验,观察现象 | 试管中均产生气泡,带火星的木条均复燃 |
| Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag | |
| Ⅳ.分别量取5 mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象 |
【实验结论】(1)实验Ⅱ、Ⅲ证明:氧化铁的
(2)写出氧化铁催化过氧化氢分解的符号表达式:
【实验评价】(3)设计实验Ⅳ的目的是
(4)若实验Ⅳ观察到D试管中产生气泡的速率更快,由此可以得到的结论是
(5)还有哪些因素可能影响该反应的速率呢?请说出你的一个猜想:
(6)请设计实验证明你的猜想(实验包括步骤、现象、结论):
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网




