科学探究题 较难0.4 引用2 组卷609
某化学拓展课堂的主题是:探秘氯化钠样品。
主题Ⅰ 探究氯化钠样品中杂质的成分
已知所提供的氯化钠样品中,可能含有硫酸钠、氯化镁、氯化钙中的一种或几种杂质。甲同学的实验探究过程记录如下:

根据以上实验信息,甲同学得出结论:此氯化钠样品中含有的杂质是硫酸钠。
【实验分析】
(1)步骤①中加入适量NaOH 溶液的目的是_____ 。
(2)乙同学认为步骤③中不需要加入足量稀盐酸,你是否同意他的观点?_____ (选填“同意”或“不同意”),请说明原因_________ 。
主题Ⅱ 测定氯化钠样品中氯化钠的质量分数
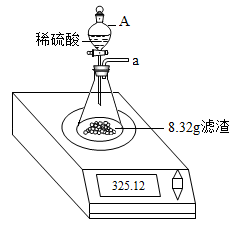
确定了氯化钠样品中杂质的成分后,甲同学对样品中氯化钠的质量分数进行测定。称取20.0g 氯化钠样品于烧杯中,加足量的水充分溶解,再向其中加入氯化钡溶液至不再产生沉淀为止,沉淀经过滤、洗涤、干燥后称量,其质量为 2.33g。该样品中氯化钠的质量分数是_____ 。(写出计算步骤,计算结果精确到 0.1%)
主题Ⅰ 探究氯化钠样品中杂质的成分
已知所提供的氯化钠样品中,可能含有硫酸钠、氯化镁、氯化钙中的一种或几种杂质。甲同学的实验探究过程记录如下:

根据以上实验信息,甲同学得出结论:此氯化钠样品中含有的杂质是硫酸钠。
【实验分析】
(1)步骤①中加入适量NaOH 溶液的目的是
(2)乙同学认为步骤③中不需要加入足量稀盐酸,你是否同意他的观点?
主题Ⅱ 测定氯化钠样品中氯化钠的质量分数
确定了氯化钠样品中杂质的成分后,甲同学对样品中氯化钠的质量分数进行测定。称取20.0g 氯化钠样品于烧杯中,加足量的水充分溶解,再向其中加入氯化钡溶液至不再产生沉淀为止,沉淀经过滤、洗涤、干燥后称量,其质量为 2.33g。该样品中氯化钠的质量分数是
2019·山东青岛·中考真题
类题推荐
NaCl、Na2CO3、NaHCO3、CaCO3是生活中常见的盐,为学习鉴别它们的方法,老师拿来了标有A、B、C、D的这四种白色固体,并提供以下资料。
【查阅资料】(1)Ca(HCO3)2可溶于水;
(2) ;Na2CO3的热稳定性好,受热不分解。
;Na2CO3的热稳定性好,受热不分解。
(3)不同温度下,Na2CO3、NaHCO3的溶解度如下表:
【设计方案】为完成鉴别,同学们分别设计了自己的实验方案。
(1)小芳的实验中,步骤1鉴别出来的物质是________ 。
(2)小明和小刚的步骤1都是溶解,该步实验的目的是__________________ 。
【进行实验】小刚进行步骤2时,发现在两支试管中产生了白色沉淀,小刚推测它们是Na2CO3、NaHCO3。则NaHCO3与石灰水反应的产物可能是_______________ 。
【反思与评价】(1)小刚的设计能完成鉴别吗?为什么?
______________________ 。
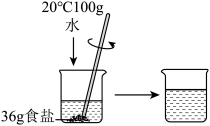
(2)小丽觉得大家的方案太麻烦,她跟老师要了一些氯化钠,做了如图所示的实验,由该实验得出的结论是______________ 。
在此实验基础上,小丽用一步完成了鉴别,她的操作是_______ 。
【查阅资料】(1)Ca(HCO3)2可溶于水;
(2)
(3)不同温度下,Na2CO3、NaHCO3的溶解度如下表:
盐 | 0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | 40 ℃ |
Na2CO3 | 7.0 g | 12.5 g | 21.5 g | 39.7 g | 49.0 g |
NaHCO3 | 6.9 g | 8.1 g | 9.6 g | 11.1 g | 12.7 g |
【设计方案】为完成鉴别,同学们分别设计了自己的实验方案。
| 设计者 | 1 | 2 | 3 |
小芳 | 加盐酸 | 溶解 | 加热 |
小明 | 溶解 | 加盐酸 | 加热 |
小刚 | 溶解 | 加石灰水 | 加盐酸 |
(1)小芳的实验中,步骤1鉴别出来的物质是
(2)小明和小刚的步骤1都是溶解,该步实验的目的是
【进行实验】小刚进行步骤2时,发现在两支试管中产生了白色沉淀,小刚推测它们是Na2CO3、NaHCO3。则NaHCO3与石灰水反应的产物可能是
【反思与评价】(1)小刚的设计能完成鉴别吗?为什么?
(2)小丽觉得大家的方案太麻烦,她跟老师要了一些氯化钠,做了如图所示的实验,由该实验得出的结论是

在此实验基础上,小丽用一步完成了鉴别,她的操作是
氯化钠是一种生活中常见的盐,在实验、生产、生活中有广泛的用途。
(一)配制50g质量分数为6%的氯化钠溶液
(1)计算。需要氯化钠______ g,蒸馏水______ mL。
(2)称量、量取。用量筒量取水的体积时,量筒必须放平,视线要与______ 保持水平,再读出水的体积。
(3)溶解。用玻璃棒搅拌的目的是______ 。
(4)装瓶、贴标签。
(二)探究氯化钠溶液的导电性
【查阅资料】
溶液的导电性可以用电导率传感器等测定出的电导率数值大小进行衡量。电导率数值越大,溶液的导电性越强。一定条件下,电导率的大小还能反映离子浓度大小。
【实验探究1】氯化钠溶液的导电性是否受溶液浓度和温度的影响?
【进行实验1】30℃时,测定不同浓度氯化钠溶液的电导率,将数据记录下表。
【进行实验2】测定不同温度、不同浓度氯化钠溶液的电导率。
【实验结论】
(1)根据实验1,能够得出的结论是______ ;
(2)根据实验2,能够得出的结论是______ 。
【实验探究2】氯化钠溶于水形成溶液的过程中,导电性如何变化?
第一步:室温为26℃时,取100mL蒸馏水,加入烧杯中,放入磁力搅拌器磁珠;
第二步:校准传感器,组装仪器,设定搅拌档位;
第三步:用电导率传感器采集数据,迅速将一定质量的氯化钠加入烧杯中、实验数据如图所示。
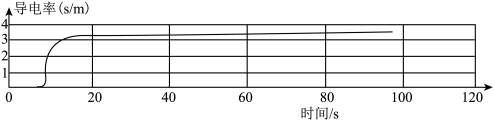
请说明实验过程中液体的电导率变化的原因______ 。
(三)电解饱和氯化钠溶液
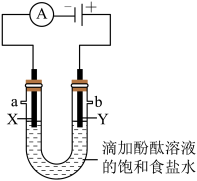
工业上用电解饱和食盐水的方法生产烧碱、氢气、氯气等化工产品。某学习小组在老师的指导下,用自制的实验装置(如图所示)进行电解饱和食盐水制取氢氧化钠的实验。
【查阅资料】:Ι、在氯化钠溶液中存在Na+、Cl-、H+、OH-四种离子。
Ⅱ、氯气能使湿润的淀粉碘化钾试纸变蓝。
【实验探究】
接通电源一段时间后,观察到X、Y电极周围均有气泡产生,溶液由无色变为红色。用小试管在a端收集气体,移近酒精灯火焰,松开拇指,发出轻微的爆鸣声,说明该气体为______ 。将湿润的淀粉碘化钾试纸放在b端,试纸变蓝。电解饱和食盐水的化学方程式是______ 。
【实验反思】电解水时,为增加导电性可向水中加入稀硫酸或氢氧化钠溶液,______ (填可以或不可以)加入氯化钠溶液进行水的电解。
(一)配制50g质量分数为6%的氯化钠溶液
(1)计算。需要氯化钠
(2)称量、量取。用量筒量取水的体积时,量筒必须放平,视线要与
(3)溶解。用玻璃棒搅拌的目的是
(4)装瓶、贴标签。
(二)探究氯化钠溶液的导电性
【查阅资料】
溶液的导电性可以用电导率传感器等测定出的电导率数值大小进行衡量。电导率数值越大,溶液的导电性越强。一定条件下,电导率的大小还能反映离子浓度大小。
【实验探究1】氯化钠溶液的导电性是否受溶液浓度和温度的影响?
【进行实验1】30℃时,测定不同浓度氯化钠溶液的电导率,将数据记录下表。
| 氯化钠溶液浓度(%) | 1.4 | 2.8 | 4.2 | 5.6 | 7.0 |
| 电导率值(S/m) | 2.000 | 3.219 | 4.533 | 5.800 | 7.133 |
| 氯化钠溶液浓度(%) | 1.4 | 5.6 | 13.0 |
| 变化曲线 |  | 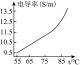 | 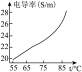 |
(1)根据实验1,能够得出的结论是
(2)根据实验2,能够得出的结论是
【实验探究2】氯化钠溶于水形成溶液的过程中,导电性如何变化?
第一步:室温为26℃时,取100mL蒸馏水,加入烧杯中,放入磁力搅拌器磁珠;
第二步:校准传感器,组装仪器,设定搅拌档位;
第三步:用电导率传感器采集数据,迅速将一定质量的氯化钠加入烧杯中、实验数据如图所示。

请说明实验过程中液体的电导率变化的原因
(三)电解饱和氯化钠溶液
工业上用电解饱和食盐水的方法生产烧碱、氢气、氯气等化工产品。某学习小组在老师的指导下,用自制的实验装置(如图所示)进行电解饱和食盐水制取氢氧化钠的实验。

【查阅资料】:Ι、在氯化钠溶液中存在Na+、Cl-、H+、OH-四种离子。
Ⅱ、氯气能使湿润的淀粉碘化钾试纸变蓝。
【实验探究】
接通电源一段时间后,观察到X、Y电极周围均有气泡产生,溶液由无色变为红色。用小试管在a端收集气体,移近酒精灯火焰,松开拇指,发出轻微的爆鸣声,说明该气体为
【实验反思】电解水时,为增加导电性可向水中加入稀硫酸或氢氧化钠溶液,
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网