科学探究题 较难0.4 引用2 组卷202
化学兴趣小组在实验室用氯酸钾和二氧化锰混合加热制取氧气。某次实验时偶然发现制得的气体有刺激性气味,这一现象引起了同学们的兴趣,于是在老师的指导下对该气体成分进行探究。
【提出问题】氯酸钾与二氧化锰混合加热后产生的气体成分是什么?
【查阅资料】
①氯酸钾与二氧化锰混合加热产生的气体只以单质形式存在;
②氯气( )是有刺激性气味的气体,能溶于水,能使湿润的淀粉碘化钾试纸变蓝。
)是有刺激性气味的气体,能溶于水,能使湿润的淀粉碘化钾试纸变蓝。
【猜想假设】
猜想一:该气体为 ;猜想二:该气体为
;猜想二:该气体为______ ,猜想三:该气体为 和
和 的混合物。
的混合物。
【实验探究】
【反思评价】
为什么两种方案得出的结论不一致?哪个是正确的?
同学:方案I结论不正确,其操作不合理,不合理之处是______ 。
老师:不需要进行实验,就能排除猜想一,理由是______ 。
【拓展应用】 不仅能作催化剂还可以作反应物,实验室通常用
不仅能作催化剂还可以作反应物,实验室通常用 与浓盐酸共热制取
与浓盐酸共热制取 ,同时生成
,同时生成 价的锰的氯化物和另一种常见的化合物,请写出该反应的化学方程式:
价的锰的氯化物和另一种常见的化合物,请写出该反应的化学方程式:______ 。
【提出问题】氯酸钾与二氧化锰混合加热后产生的气体成分是什么?
【查阅资料】
①氯酸钾与二氧化锰混合加热产生的气体只以单质形式存在;
②氯气(
【猜想假设】
猜想一:该气体为
【实验探究】
| 序号 | 操作 | 现象 | 结论 |
| 方案I | 用排水集气法收集甲、乙两瓶气体,将带火星的木条伸入甲瓶,湿润的淀粉碘化钾试纸伸入乙瓶。 | 木条复燃, 淀粉碘化钾试纸不变色 | 猜想 |
| 方案II | 向上排空气法收集甲、乙两瓶气体,将带火星的木条伸入甲瓶,湿润的淀粉碘化钾试纸伸入乙瓶。 | 木条 淀粉碘化钾试纸为 | 猜想三成立 |
【反思评价】
为什么两种方案得出的结论不一致?哪个是正确的?
同学:方案I结论不正确,其操作不合理,不合理之处是
老师:不需要进行实验,就能排除猜想一,理由是
【拓展应用】
19-20九年级上·山东临沂·期末
类题推荐
镁条在空气中剧烈燃烧,发出耀眼的白光,生成白色固体,细心的小明同学发现,镁条燃烧除生成白色固体外,还有少量的淡黄色固体生成,经查阅资料得知:
(1)淡黄色固体是由镁条和空气中的氮气化合产生的,生成的氮化镁的化学式为___________ 。他还发现镁条在空气中久置表面会变黑,实验小组同学设计并进行实验,探究镁条变黑的条件。
【猜想假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应生成硫酸钠;浓硫酸具有强的吸水性,氢氧化钠溶液可吸收CO2。
【设计实验】通过控制与镁条接触的物质,利用下图装置(镁条长度为,3cm试管容积为20mL),分别进行下列5个实验,并持续观察20天。
【解释与结论】
(2)①实验1的目的是___________ ;
②实验3中,试管内气体主要含CO2和___________ ;
③实验4中,Na2SO3溶液的作用是___________ (用化学方程式表示);
④得出“镁条变黑一定与CO2有关”的结论,依据的两个实验是___________ (填序号);
⑤由上述实验可知,镁条变黑的条件是___________ 。
【反思与评价】
(3)①在猜想假设时,同学们认为镁条变黑与N2无关,理由是___________ ;
②镁表面黑色物质是 (以下用M表示)。已知
(以下用M表示)。已知 受热会分解为MgO、CO2和H2O,现取14.2gM充分加热,得剩余固体8.0g、CO24.4g,则M中x:y=
受热会分解为MgO、CO2和H2O,现取14.2gM充分加热,得剩余固体8.0g、CO24.4g,则M中x:y=___________ (填数字)。
(1)淡黄色固体是由镁条和空气中的氮气化合产生的,生成的氮化镁的化学式为
【猜想假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应生成硫酸钠;浓硫酸具有强的吸水性,氢氧化钠溶液可吸收CO2。
【设计实验】通过控制与镁条接触的物质,利用下图装置(镁条长度为,3cm试管容积为20mL),分别进行下列5个实验,并持续观察20天。
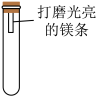
| 编号 | 主要实验操作 | 实验现象 |
| 1 | 先充满用NaOH浓溶液洗涤过的空气再加入2mL浓硫酸 | 镁条始终无明显变化 |
| 2 | 加入2mL NaOH浓溶液 | 镁条始终无明显变化 |
| 3 | 先加入2mL浓硫酸再通入约4mL CO2 | 镁条始终无明显变化 |
| 4 | 先加入4mL饱和Na2SO3溶液再充满CO2 | 镁条始终无明显变化 |
| 5 | 先加入2mL蒸馏水再通入约4mL CO2 | 美条第3天开始变黑 至第20天全部变黑 |
(2)①实验1的目的是
②实验3中,试管内气体主要含CO2和
③实验4中,Na2SO3溶液的作用是
④得出“镁条变黑一定与CO2有关”的结论,依据的两个实验是
⑤由上述实验可知,镁条变黑的条件是
【反思与评价】
(3)①在猜想假设时,同学们认为镁条变黑与N2无关,理由是
②镁表面黑色物质是
某化学兴趣小组在学习氨分子扩散实验时对这种有刺激性气味的气体产生了浓厚的兴趣,对其性质进行了探究性学习。
【查阅资料】
①氨气( )是一种有刺激性气味的气体,极易溶于水。在高浓度氧气中氨气才能燃烧,生成氮气和水。
)是一种有刺激性气味的气体,极易溶于水。在高浓度氧气中氨气才能燃烧,生成氮气和水。
②氨气有还原性,在加热条件下可还原氧化铜。
③ 是红色固体,不溶于水,可与稀硫酸发生反应:
是红色固体,不溶于水,可与稀硫酸发生反应: 。
。
(1)产生喷泉现象的原因是________ 。
【实验2】乙同学设计如图2的实验装置验证氦气在氧气中燃烧:将过量的氧气与氨气分别从a、b两管进气口通入,并在b管上端点燃氨气。
(2)实验时需先通入氧气,后通入氨气,理由是________ 。
【实验3】丙同学利用图3装置进行 的还原性实验探究(夹持装置已略去)。
的还原性实验探究(夹持装置已略去)。________ ,二者混合可制取氨气。
a.碱石灰 b.生石灰 c.浓硫酸 d.熟石灰
(4)若D中生成的固体粉末全部是铜,E中无水硫酸铜变成蓝色,且生成物之一是空气中含量最多的气体,则氨气还原氧化铜的化学方程式为________ 。
(5)查阅资料得知:酒精灯加热时达不到高温,生成物中可能有 。为探究氨气与氧化铜反应后所得固体粉末的成分,继续进行如下实验:
。为探究氨气与氧化铜反应后所得固体粉末的成分,继续进行如下实验:
(6)为进一步确定生成物中 的质量分数,丁同学称取10g固体粉末,滴加稀硫酸至固体的量不再变化时,过滤、洗涤、干燥、称重固体质量为8g,请计算固体中
的质量分数,丁同学称取10g固体粉末,滴加稀硫酸至固体的量不再变化时,过滤、洗涤、干燥、称重固体质量为8g,请计算固体中 的质量分数。
的质量分数。________
(7)实验后小组同学认为该套装置存在明显的缺陷,该缺陷是________ 。
【查阅资料】
①氨气(
②氨气有还原性,在加热条件下可还原氧化铜。
③
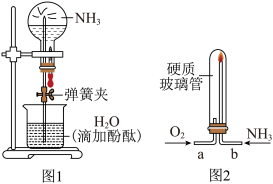
(1)产生喷泉现象的原因是
【实验2】乙同学设计如图2的实验装置验证氦气在氧气中燃烧:将过量的氧气与氨气分别从a、b两管进气口通入,并在b管上端点燃氨气。
(2)实验时需先通入氧气,后通入氨气,理由是
【实验3】丙同学利用图3装置进行
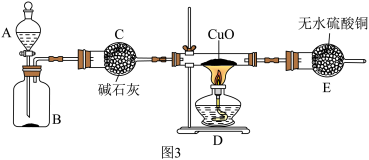
a.碱石灰 b.生石灰 c.浓硫酸 d.熟石灰
(4)若D中生成的固体粉末全部是铜,E中无水硫酸铜变成蓝色,且生成物之一是空气中含量最多的气体,则氨气还原氧化铜的化学方程式为
(5)查阅资料得知:酒精灯加热时达不到高温,生成物中可能有
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量固体粉末于试管中,滴加足量稀硫酸。 | 生成物中有 |
(6)为进一步确定生成物中
(7)实验后小组同学认为该套装置存在明显的缺陷,该缺陷是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网