科学探究题 较易0.85 引用1 组卷73
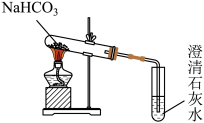
醋是中国传统的调味品,市场上售卖的某一品牌白醋,标签说明,除了3%﹣5%的醋酸( CH3COOH)和水之外不含或极少含其他成分醋酸在水溶液中能电离出醋酸根离子(CH3COO﹣)和H+,请回答相应问题:
(1)白醋是______ (填“纯净物”或“混合物”)。
(2)酿醋原理是在醋酸菌作用下乙醇(C2H5OH)与氧气反应,除生成醋酸外,还生成一种日常生活中最常见的物质,请写出该反应的化学方程式:______ 。
(3)某同学对白醋的性质进行如下探究:
(1)白醋是
(2)酿醋原理是在醋酸菌作用下乙醇(C2H5OH)与氧气反应,除生成醋酸外,还生成一种日常生活中最常见的物质,请写出该反应的化学方程式:
(3)某同学对白醋的性质进行如下探究:
| 实验操作 | 实验现象 | 实验结论与解释 |
| ①向白醋中滴入 | 观察到溶液变红 | 白醋显酸性 |
| ②向镁粉中滴加白醋直至过量 | 白醋能与活泼金属反应 | |
| ③向滴有酚酞试液的氢氧化钠溶液中滴加白醋至过量 | 白醋能与碱发生中和反应,反应的化学方程式为 | |
| ④将白醋滴加到碳酸钙表面 | 白醋能与某些盐反应 |
19-20九年级上·山东淄博·期末
类题推荐
同学们对膨松剂能使油条膨胀这一现象产生了浓厚的兴趣,于是围绕膨松剂的成分和原理进行了如下项目式探究。
【查阅资料】
a.某膨松剂配料表成分:碳酸氢钠、磷酸二氢钙 、玉米淀粉。
、玉米淀粉。
b.玉米淀粉是一种填充剂,不参与反应。
任务一:探究膨松剂使油条膨胀的气体是如何产生的?
【作出猜想】Ⅰ、碳酸氢钠能与磷酸二氢钙反应产生气体;
Ⅱ、碳酸氢钠受热会分解产生气体。
【实验探究】
(1)设计实验方案并完成如下实验。
【实验结论】
使油条膨胀的气体既来自发面、醒面过程中碳酸氢钠与磷酸二氢钙的反应,又来自油炸过程中碳酸氢钠的受热分解。
【提出问题】碳酸钠与碳酸氢钠都能与酸反应产生气体,碳酸钠适合作膨松剂吗?
任务二:探究碳酸钠能否作膨松剂。
【实验探究】
(2)设计实验方案并完成如下实验。(装置气密性良好)
【得出结论】碳酸钠不适合作膨松剂。
【讨论交流】
(3)同学们认为若想得出上述结论,还需要补充的实验是______ 。
(4)存放膨松剂时的注意事项是______ (写一条)。
【查阅资料】
a.某膨松剂配料表成分:碳酸氢钠、磷酸二氢钙
b.玉米淀粉是一种填充剂,不参与反应。
任务一:探究膨松剂使油条膨胀的气体是如何产生的?
【作出猜想】Ⅰ、碳酸氢钠能与磷酸二氢钙反应产生气体;
Ⅱ、碳酸氢钠受热会分解产生气体。
【实验探究】
(1)设计实验方案并完成如下实验。
| 实验步骤 | 实验现象或结果 | 实验结论 | |
| ① | 取少量磷酸二氢钙固体于试管中,加水充分溶解,测定溶液的pH | 磷酸二氢钙溶液呈 | |
| ② | 向盛有膨松剂的试管中加入水 | ||
| ③ |
| 澄清石灰水变浑浊 | 猜想Ⅱ成立。 使澄清石灰水变浑浊的化学方程式为 |
【实验结论】
使油条膨胀的气体既来自发面、醒面过程中碳酸氢钠与磷酸二氢钙的反应,又来自油炸过程中碳酸氢钠的受热分解。
【提出问题】碳酸钠与碳酸氢钠都能与酸反应产生气体,碳酸钠适合作膨松剂吗?
任务二:探究碳酸钠能否作膨松剂。
【实验探究】
(2)设计实验方案并完成如下实验。(装置气密性良好)
| 实验步骤 | 实验现象或结果 | 实验结论 | |
| ① | 分别取等浓度的 | ||
| ② |
|
| 质量相同时, |
【得出结论】碳酸钠不适合作膨松剂。
【讨论交流】
(3)同学们认为若想得出上述结论,还需要补充的实验是
(4)存放膨松剂时的注意事项是
镁是初中化学中常见的一种金属。小莫同学欲探究镁的制备方法及镁的一些化学性质。
一、目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
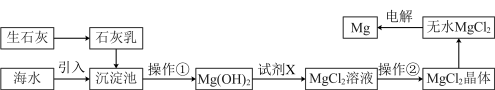
提示:①MgCl2晶体的化学式为MgCl2•6H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃.
(1)操作①的名称是___________
(2)试剂X的名称_____________
(3)用氯化镁电解生产金属镁的化学方程式为:___________________
(4)工业上是将氢氧化镁转变为氯化镁,再电解熔融氯化镁来制取镁单质;而不采用加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是_____________________
二、小莫同学用上述制得的镁与稀盐酸反应。
将打磨后的镁条放入盐酸中,观察到有灰白色沉淀生成的“异常”现象,引起了他的兴趣并进行了以下探究;
【初步探究】出现灰白色沉淀是否为偶然现象
【实验Ⅰ】向4份相同体积与浓度的稀盐酸中加入一定长度的镁带,现象如下:
【实验结论】并非偶然,据表分析, ________________ 是实验出现“异常”的主要因素;
【再次探究】该沉淀的成分
【猜想假设】猜想1:Mg;猜想2:MgCl2
【实验Ⅱ】
【交流讨论】
(1)莫凡同学做出猜想1的依据是他认为反应物Mg过量,做出猜想2的依据是他认为生成物MgCl2_________________________ ;
(2)从实验设计的角度讲,实验③的作用是_______________ ;
【深入探究】该沉淀的物质的组成
【查阅资料】
灰白色沉淀的成分为碱式氯化镁,它存在多种组成,化学式可表示为Mgx(OH)yClx•nH2O,它受热分解可以产生氧化镁,氯化氢和水;
【实验Ⅲ】
洗去沉淀表面杂质并室温晾干,取其7.07g,用如图装置(夹持仪器未画出)按照正确的操作步骤进行实验,待反应停止后,测得硬质玻璃管中剩余固体质量为4.00g,装置B的质量增加了2.34g;
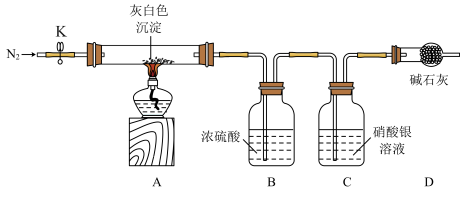
【问题讨论】
(1)反应停止后,应继续通入氮气一段时间,目的_______________________________ ;
(2)该沉淀中镁、氯离子个数比n(Mg2+) : n(Cl-) =______________ ;(写出计算步骤)
(3)若该沉淀Mgx(OH)yClx•nH2O中,n=5,则x、y、z的比值为____________ 。
一、目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:

提示:①MgCl2晶体的化学式为MgCl2•6H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃.
(1)操作①的名称是
(2)试剂X的名称
(3)用氯化镁电解生产金属镁的化学方程式为:
(4)工业上是将氢氧化镁转变为氯化镁,再电解熔融氯化镁来制取镁单质;而不采用加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是
二、小莫同学用上述制得的镁与稀盐酸反应。
将打磨后的镁条放入盐酸中,观察到有灰白色沉淀生成的“异常”现象,引起了他的兴趣并进行了以下探究;
【初步探究】出现灰白色沉淀是否为偶然现象
【实验Ⅰ】向4份相同体积与浓度的稀盐酸中加入一定长度的镁带,现象如下:
| 实验组别 | A | B | C | D |
| 镁带长度 | 1cm | 3cm | 3cm | 4cm |
| 沉淀量 | 无沉淀生成 | 少量沉淀 | 沉淀较多 | 沉淀很多 |
【再次探究】该沉淀的成分
【猜想假设】猜想1:Mg;猜想2:MgCl2
【实验Ⅱ】
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 取1g样品,加入足量 | 未见气泡 | 猜想1错误 |
| ② | 取1g样品,加入5mL蒸馏水,振荡 | 沉淀未见溶解 | 猜想2错误 |
| ③ | 取1gMgCl2固体,加5mL蒸馏水,振荡 | 固体全部溶解 |
(1)莫凡同学做出猜想1的依据是他认为反应物Mg过量,做出猜想2的依据是他认为生成物MgCl2
(2)从实验设计的角度讲,实验③的作用是
【深入探究】该沉淀的物质的组成
【查阅资料】
灰白色沉淀的成分为碱式氯化镁,它存在多种组成,化学式可表示为Mgx(OH)yClx•nH2O,它受热分解可以产生氧化镁,氯化氢和水;
【实验Ⅲ】
洗去沉淀表面杂质并室温晾干,取其7.07g,用如图装置(夹持仪器未画出)按照正确的操作步骤进行实验,待反应停止后,测得硬质玻璃管中剩余固体质量为4.00g,装置B的质量增加了2.34g;

【问题讨论】
(1)反应停止后,应继续通入氮气一段时间,目的
(2)该沉淀中镁、氯离子个数比n(Mg2+) : n(Cl-) =
(3)若该沉淀Mgx(OH)yClx•nH2O中,n=5,则x、y、z的比值为
以下是同学们对木炭粉还原氧化铜的有关探究。
(1)同学们用如图进行实验。酒精灯火焰处加有金属网罩,其作用是_______ ,一段时间后观察到试管a中的现象是_______ 。
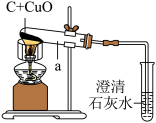
(2)发现问题:实验结束时试管a中还存在黑色粉末。试管a中剩余物质中的黑色粉末是什么呢?
【提出猜想】猜想I:是木炭粉;猜想II:是氧化铜;猜想III:是木炭粉和氧化铜。
【查阅资料】CuO能跟稀硫酸反应,会生成CuSO4,木炭粉不能跟稀硫酸反应。木炭难溶于水。
【进行实验】
请写出CuO跟稀硫酸反应的化学方程式_______ 。
【获得结论】
(3)猜想_______ 成立。
【实验反思】
(4)进行木炭还原氧化铜实验时,为使氧化铜全部还原,氧化铜和木炭粉的质量比最好是_______ (填序号)
(1)同学们用如图进行实验。酒精灯火焰处加有金属网罩,其作用是

(2)发现问题:实验结束时试管a中还存在黑色粉末。试管a中剩余物质中的黑色粉末是什么呢?
【提出猜想】猜想I:是木炭粉;猜想II:是氧化铜;猜想III:是木炭粉和氧化铜。
【查阅资料】CuO能跟稀硫酸反应,会生成CuSO4,木炭粉不能跟稀硫酸反应。木炭难溶于水。
【进行实验】
| 实验步骤 | 实验现象 | 结论或分析 |
| 取一些剩余固体于试管中,向试管中加入足量的稀硫酸 | 部分固体溶解,无色溶液变蓝色 | 黑色粉末是 |
【获得结论】
(3)猜想
【实验反思】
(4)进行木炭还原氧化铜实验时,为使氧化铜全部还原,氧化铜和木炭粉的质量比最好是
| A.80:6 | B.80:5 | C.80:7 | D.任意比 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网