科学探究题 较难0.4 引用19 组卷1298
化学实验过程经常会产生一定量的废液,经过无害化处理可有效防止水体污染。在一次实验课上,兴趣小组的同学们完成了NaOH溶液和Na2CO3溶液的鉴别,并对废液成分展开探究。
活动一
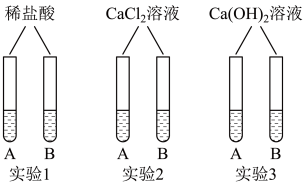
通过小组合作,同学们完成了右图所示的三组小实验。实验中生成白色沉淀的化学方程式是____________________ (写一个)。
活动二
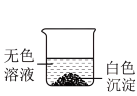
小雪将六支试管中的剩余物倒入一个洁净的大烧杯中(如下图), 充分搅拌、静置。观察到杯内上层是无色溶液,下层有白色沉淀。由此可以确定:上层溶液中一定不含有的离子是__________________ 、以及一定含有的离子。小组同学对上层溶液中还可能含有的离子进行了如下探究。
【提出问题】上层溶液中还可能含有什么离子?
【猜想与假设】上层溶液中还可能含有OH-、CO32-、Ca2+中的一种或几种。
【进行实验】
【反思与评价】
(1)小明同学对方案一提出质疑, 他的理由是________________________ 。
(2)经过综合分析,最终确定上层溶液中肯定存在的离子有______________________ 。
(3)将烧杯内物质过滤,滤渣回收,向滤液中加入适量_______________________ 进行处理后再排放。

活动一
通过小组合作,同学们完成了右图所示的三组小实验。实验中生成白色沉淀的化学方程式是
活动二
小雪将六支试管中的剩余物倒入一个洁净的大烧杯中(如下图), 充分搅拌、静置。观察到杯内上层是无色溶液,下层有白色沉淀。由此可以确定:上层溶液中一定不含有的离子是

【提出问题】上层溶液中还可能含有什么离子?
【猜想与假设】上层溶液中还可能含有OH-、CO32-、Ca2+中的一种或几种。
【进行实验】
| 实验步骤 | 实验现象 | 实验结论 | |
| 方案一 | ①取少量溶液于试管中,滴加无色酚酞溶液②继续滴加稀盐酸 | ①溶液变红 ②产生气泡 | ①有OH- ②有CO32-、无Ca2+ |
| 方案二 | 取少量溶液于试管中, | ① ② | ①有CO32-、无Ca2+ ②有OH- |
【反思与评价】
(1)小明同学对方案一提出质疑, 他的理由是
(2)经过综合分析,最终确定上层溶液中肯定存在的离子有
(3)将烧杯内物质过滤,滤渣回收,向滤液中加入适量
2018·山西·中考真题
类题推荐
某化学兴趣小组进行“铁丝在氧气中燃烧”的实验,并进行了一些探究活动,请你一同参与。
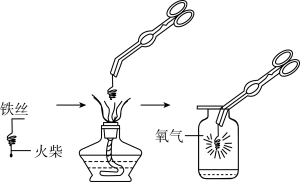
铁丝在空气中能否燃烧________ (填写“能”或“否”),铁丝在氧气中燃烧实验的示意图如图,图中螺旋状铁丝的末端系一根火柴的作用是______ ;集气瓶中先放一些水的作用是_______ 。
【探究一】铁丝燃烧是否需要纯氧?
【实验内容】取直径为0.38mm的铁丝,分别在体积分数为90%、70%、60%、55%的氧气中实验。实验现象如表所示:
【结论1】就0.38mm铁丝而言,铁丝燃烧对氧气体积分数的要求是___________ (选填“>”“=”或“<”)55%,且氧气浓度越大,燃烧现象越___________ (填“剧烈”或“不剧烈”);
【讨论】如果实验中所用集气瓶的容积为125mL,实验时集气瓶中需留25mL水,如果需收集100mL体积分数为80%的氧气,其操作方法是先在集气瓶中装___________ mL水,然后用排水法收集,直到剩下25mL水。(空气中氧气的体积分数计为20%)
【探究二】铁丝燃烧为什么会火星四射?
【资料】生活中常见的铁都不是纯净的铁,都含有一定量的碳。
【设计与实验2】小明将直径都为0.38mm的纯铁丝和不同含碳量的铁丝放入氧气中燃烧,实验现象记录如表,请你分析完成下表:
【结论2】通过以上实验,说明铁丝燃烧产生火星四射现象和含碳量___________ (选填“有关”或“无关”),请写出铁丝在氧气中燃烧的化学方程式________ 。
铁丝在空气中能否燃烧

【探究一】铁丝燃烧是否需要纯氧?
【实验内容】取直径为0.38mm的铁丝,分别在体积分数为90%、70%、60%、55%的氧气中实验。实验现象如表所示:
| 氧气% | 90% | 70% | 60% | 55% |
| 实验现象 | 燃烧剧烈、燃烧时间长,效果好 | 燃烧比90%弱,燃烧时间短,实验成功 | 燃烧比70%弱,燃烧时间更短,实验成功 | 难以燃烧,只是发红 |
【讨论】如果实验中所用集气瓶的容积为125mL,实验时集气瓶中需留25mL水,如果需收集100mL体积分数为80%的氧气,其操作方法是先在集气瓶中装
【探究二】铁丝燃烧为什么会火星四射?
【资料】生活中常见的铁都不是纯净的铁,都含有一定量的碳。
【设计与实验2】小明将直径都为0.38mm的纯铁丝和不同含碳量的铁丝放入氧气中燃烧,实验现象记录如表,请你分析完成下表:
| 物质 | 纯铁丝 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
| 燃烧时的现象 | 无火星四射现象,熔断 | 剧烈燃烧极少火星 | 剧烈燃烧,火星四射 | |
某自热火锅发热包的成分表如下,同学们以“探索自热火锅的奥秘”为主题进行了项目式探究。
任务一:验证发热包中的部分物质
【实验验证】
(1)
【分析交流】
(2)经过讨论分析,同学们认为步骤Ⅱ中的实验结论不合理,理由是______ (用化学反应方程式说明)
任务二:探究发热包的发热原理
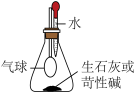
(3)同学们利用如图装置证明发热包放热主要来自于生石灰和苛性钠遇水放热。加水后发现气球______ (填“变大”、“变小”或“不变”),但很快恢复原状,说明放热过程很快结束,不能长时间保温。
【分析交流】同学们认为发热包放热还与铁粉的缓慢氧化有关。
为进一步探究发热包中的铁粉能快速发热的原因,同学们按照下表利用图2装置进行实验,得到曲线如图3所示。
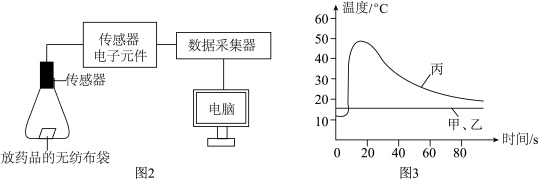
(4)方案乙需要补充的药品是______ 。
(5)分析图3可知铁粉迅速发热的原因是______ 。
【实验结论】发热包的工作原理是生石灰与苛性钠遇水放热使水快速沸腾,铁粉的氧化放热起到长时间保温的作用。
任务三:探究发热包的保存及使用注意事项
(6)久置在空气中的发热包,其主要成分生石灰最终转化成______ (填化学式),故应密封防潮保存。
(7)同学们查阅资料得知发热包中的铝粉可与氢氧化钠溶液发生反应生成偏铝酸钠(NaAlO2)和氢气,该反应的化学方程式为______ 。故使用发热包时要避免在密闭空间内接触明火,以防发生爆燃事故。
| 主要成分 生石灰、苛性钠、铁粉、铝粉、碳粉、氯化钠等 |
【实验验证】
(1)
| 实验步骤 | 实验现象 | 实验结论 |
| Ⅰ、取少许发热包中固体粉末用磁铁靠近 | 有黑色粉末被吸引 | 发热包中含有 |
| Ⅱ、向Ⅰ所得剩余固体中加入足量水溶解并过滤,向滤液中滴入酚酞 | 发热包中含有苛性钠 |
【分析交流】
(2)经过讨论分析,同学们认为步骤Ⅱ中的实验结论不合理,理由是
任务二:探究发热包的发热原理
(3)同学们利用如图装置证明发热包放热主要来自于生石灰和苛性钠遇水放热。加水后发现气球

【分析交流】同学们认为发热包放热还与铁粉的缓慢氧化有关。
为进一步探究发热包中的铁粉能快速发热的原因,同学们按照下表利用图2装置进行实验,得到曲线如图3所示。
| 实验方案 | 实验药品 |
| 甲 | 5g铁粉、4mL水、3g氯化钠 |
| 乙 | 5g铁粉、4mL水、______ |
| 丙 | 5g铁粉、4mL水、3g活性炭、3g氯化钠 |

(4)方案乙需要补充的药品是
(5)分析图3可知铁粉迅速发热的原因是
【实验结论】发热包的工作原理是生石灰与苛性钠遇水放热使水快速沸腾,铁粉的氧化放热起到长时间保温的作用。
任务三:探究发热包的保存及使用注意事项
(6)久置在空气中的发热包,其主要成分生石灰最终转化成
(7)同学们查阅资料得知发热包中的铝粉可与氢氧化钠溶液发生反应生成偏铝酸钠(NaAlO2)和氢气,该反应的化学方程式为
有一种神奇的蜡烛,任你怎么吹也吹不灭,而且看上去和普通的蜡烛一模一样,那么到底是什么能让蜡烛持续燃烧?请你一起参与探究。
【查阅资料】普通蜡烛由石蜡和蜡烛芯制成,而吹不灭的蜡烛是在蜡烛芯上包裹一层打火石的粉末,打火石是由某种金属掺入少量稀土元素制成的合金,它的着火点只有150℃,当蜡烛燃烧时,金属并不燃烧;但当蜡烛吹灭后,未冷却的金属接触到氧气就发生燃烧,从而使蜡烛复燃。
【请教老师】老师告诉同学们,蜡烛芯内打火石中的某种金属是镁、铁、铜三种金属中的一种。
【进行实验】为确定该金属的成分,大家设计了以下实验方案。
【反思交流】(1)实验2中反应的化学方程式为__________________________________ 。
(2)这种蜡烛燃烧时,蜡烛芯里的金属为什么不燃烧?___________________________ ;当吹灭蜡烛时,烛芯中的金属燃烧的化学方程式为_________________________________ 。
(3)这种“吹不灭”的蜡烛实际上也可以熄灭,你采用的方法是______ 。
【查阅资料】普通蜡烛由石蜡和蜡烛芯制成,而吹不灭的蜡烛是在蜡烛芯上包裹一层打火石的粉末,打火石是由某种金属掺入少量稀土元素制成的合金,它的着火点只有150℃,当蜡烛燃烧时,金属并不燃烧;但当蜡烛吹灭后,未冷却的金属接触到氧气就发生燃烧,从而使蜡烛复燃。
【请教老师】老师告诉同学们,蜡烛芯内打火石中的某种金属是镁、铁、铜三种金属中的一种。
【进行实验】为确定该金属的成分,大家设计了以下实验方案。
| 实验操作步骤 | 实验现象 | 实验结论 |
| 1.切开蜡烛,取出打火石,用砂纸打磨 | 打火石呈银白色 | 该金属一定不是 |
| 2.取少量打磨后的打火石于试管中,滴加稀盐酸 | 有无色气体产生,反应后的溶液呈 | 该金属一定不是铁,而是镁 |
【反思交流】(1)实验2中反应的化学方程式为
(2)这种蜡烛燃烧时,蜡烛芯里的金属为什么不燃烧?
(3)这种“吹不灭”的蜡烛实际上也可以熄灭,你采用的方法是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


