科学探究题 较难0.4 引用1 组卷140
绿矾(FeSO4•7H2O)用途广泛,可用作净水剂,医学上可用作补血剂,还可用于制颜料。
(1)绿矾是一种絮凝剂,利用其溶于水后生成的胶状物对杂质的____________ ,使杂质沉降来达到净水的目的。
(2)缺铁会引起贫血,铁是一种人体必需的__________ (填“常量元素”或“微量元素”)。
(3)《本草纲目》中记载,绿矾“煅过变赤,则为绛矾”。绛矾是古代壁画、彩塑中使用的一种红色颜料。
某化学兴趣小组同学对绿矾高温分解的产物很感兴趣,进行了如下探究。
【查阅资料】
①绿矾高温分解的产物是一种固态金属氧化物和几种气态非金属氧化物。
②在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低。
③无水硫酸铜遇水变蓝。
④硫有两种常见的氧化物,部分性质如下表:
【提出问题】
《本草纲目》中记载绿矾“煅过变赤”,经实验验证绿矾高温分解确实产生红色固体,说明绿矾高温分解产生的一种固态金属氧化物是____________ ,那么产生的几种气态非金属氧化物是什么呢?
【进行猜想】猜想1:H2O 和____________ ;
猜想2:H2O 和SO3 ;
猜想3:H2O、SO2和SO3 。
甲同学认为无需通过进一步实验即可判定猜想2错误,理由是_______________________ 。
【设计实验】
乙同学用以下装置检验绿矾高温分解产生的气态非金属氧化物:
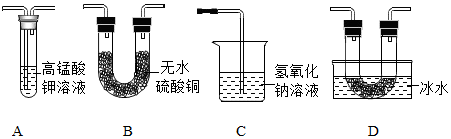
需将绿矾高温分解产生的气体依次通过______________ (填字母,且每套装置限用一次)。
【分析现象】进行上述实验,观察到A中试管内溶液________ ,B中U形管内固体 ________ ,D中U形管内出现无色晶体,说明猜想3正确。
【得出结论】绿矾高温分解的化学方程式为_______________________________________ 。
【拓展延伸】生产硫酸最古老的方法是使绿矾高温分解,将生成的SO3和H2O同时冷凝并发生反应SO3+H2O=H2SO4 ,所以古代称硫酸为“绿矾油”。假定SO3和H2O全部冷凝并充分反应,SO2全部逸出,则通过这个方法得到的硫酸的质量分数为____________ (计算结果保留一位小数)。
(1)绿矾是一种絮凝剂,利用其溶于水后生成的胶状物对杂质的
(2)缺铁会引起贫血,铁是一种人体必需的
(3)《本草纲目》中记载,绿矾“煅过变赤,则为绛矾”。绛矾是古代壁画、彩塑中使用的一种红色颜料。
某化学兴趣小组同学对绿矾高温分解的产物很感兴趣,进行了如下探究。
【查阅资料】
①绿矾高温分解的产物是一种固态金属氧化物和几种气态非金属氧化物。
②在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低。
③无水硫酸铜遇水变蓝。
④硫有两种常见的氧化物,部分性质如下表:
硫的氧化物 | 熔点 | 沸点 | 水溶性 | 能否使高锰酸钾溶液褪色 |
SO2 | -75.5℃ | -10℃ | 易溶于水 | 能 |
SO3 | 16.8℃ | 44.8℃ | 易溶于水 | 不能 |
【提出问题】
《本草纲目》中记载绿矾“煅过变赤”,经实验验证绿矾高温分解确实产生红色固体,说明绿矾高温分解产生的一种固态金属氧化物是
【进行猜想】猜想1:H2O 和
猜想2:H2O 和SO3 ;
猜想3:H2O、SO2和SO3 。
甲同学认为无需通过进一步实验即可判定猜想2错误,理由是
【设计实验】
乙同学用以下装置检验绿矾高温分解产生的气态非金属氧化物:

需将绿矾高温分解产生的气体依次通过
【分析现象】进行上述实验,观察到A中试管内溶液
【得出结论】绿矾高温分解的化学方程式为
【拓展延伸】生产硫酸最古老的方法是使绿矾高温分解,将生成的SO3和H2O同时冷凝并发生反应SO3+H2O=H2SO4 ,所以古代称硫酸为“绿矾油”。假定SO3和H2O全部冷凝并充分反应,SO2全部逸出,则通过这个方法得到的硫酸的质量分数为
2018·江苏南京·二模
类题推荐
探究稀盐酸敞口放置后浓度的变化
资料:碳酸氢钠和盐酸的反应为:NaHCO3+HCl=NaCl+H2O+CO2↑
【知识回顾】氯化氢气体溶于水形成盐酸,纯净的浓盐酸是无色液体。
(1)打开浓盐酸瓶塞,瓶口产生白雾,说明浓盐酸具有______ 性,敞口放置浓度会减小。
【任务一】探究稀盐酸敞口放置浓度会怎么变化。
在相同的条件下,将20.0g水和20.0g稀盐酸分别置于相同规格的烧杯中,并敞口存放于空气中,烧杯中物质的质量随时间变化如表:
(2)小组同学认为稀盐酸敞口久置后浓度变大。根据实验数据分析其猜想的理由______ 。
【任务二】探究稀盐酸敞口久置后浓度是否会变大。
在相同条件下,小组用一定浓度的稀盐酸分别密封、敞口放置15天,设计实验方案并探究比较浓度变化。
通过上述实验,小组得出稀盐酸敞口久置后浓度变大。
(3)实验②中V1______ V2(填“>”或“<”或“=”)。
(4)实验③中记录稀盐酸滴数依据的现象是______ ,其发生的化学反应方程式为______ 。
【任务三】探究稀盐酸敞口久置后浓度会变大的微观原因。
小组又重新设计了实验(如图1):取少量稀盐酸于试管中进行加热,在试管口放置一片湿润的蓝色的石蕊试纸,试纸变红。小组认为稀盐酸敞口放置后有氯化氢气体逸出。______ 。
(6)根据以上实验,在图2方框内绘制出敞口久置的稀盐酸上方分子种类和数目(空气中的微观粒子忽略)。______ 。
资料:碳酸氢钠和盐酸的反应为:NaHCO3+HCl=NaCl+H2O+CO2↑
【知识回顾】氯化氢气体溶于水形成盐酸,纯净的浓盐酸是无色液体。
(1)打开浓盐酸瓶塞,瓶口产生白雾,说明浓盐酸具有
【任务一】探究稀盐酸敞口放置浓度会怎么变化。
在相同的条件下,将20.0g水和20.0g稀盐酸分别置于相同规格的烧杯中,并敞口存放于空气中,烧杯中物质的质量随时间变化如表:
| 时间 | 敞口前 | 敞口1天后 | 敞口2天后 | |
| 质量/g | 水 | 20.0 | 14.2 | 11.4 |
| 稀盐酸 | 20.0 | 14.9 | 12.9 | |
(2)小组同学认为稀盐酸敞口久置后浓度变大。根据实验数据分析其猜想的理由
【任务二】探究稀盐酸敞口久置后浓度是否会变大。
在相同条件下,小组用一定浓度的稀盐酸分别密封、敞口放置15天,设计实验方案并探究比较浓度变化。
| 实验编号 | 实验方案 | 实验结论 | |
| 密封的稀盐酸 | 敞口的稀盐酸 | ||
| ① | 分别取等量上述两种稀盐酸于试管中,用pH计测定pH,记录实验数据 | pH=0.6 | pH=0.5 |
| ② | 分别取过量且等量的NaHCO3粉末于试管中,再分别注入2mL上述两种稀盐酸,记录产生的气体体积 | V1mL | V2mL |
| ③ | 分别取少量且等量NaOH溶液于试管中,各滴加2滴无色酚酞试液,再分别逐滴滴加上述两种稀盐酸,记录滴入稀盐酸的滴数 | 12滴 | 9滴 |
(3)实验②中V1
(4)实验③中记录稀盐酸滴数依据的现象是
【任务三】探究稀盐酸敞口久置后浓度会变大的微观原因。
小组又重新设计了实验(如图1):取少量稀盐酸于试管中进行加热,在试管口放置一片湿润的蓝色的石蕊试纸,试纸变红。小组认为稀盐酸敞口放置后有氯化氢气体逸出。

(6)根据以上实验,在图2方框内绘制出敞口久置的稀盐酸上方分子种类和数目(空气中的微观粒子忽略)。

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网