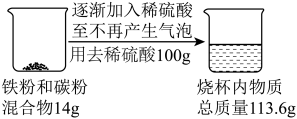
计算题 适中0.65 引用1 组卷113
某商品碳酸钙粉末包装袋上注明:碳酸钙的含量≥96%。为测定该产品中含碳酸钙的质量分数:取11.0g碳酸钙样品放入烧杯中,称得烧杯及所盛碳酸钙样品的总质量为168.0g,再把100.0g稀盐酸平均分成25.0g依次加入样品中,每次均充分反应(碳酸钙中其它成分不参加反应)。实验数据记录如下:
请你分析并计算(保留一位小数):
(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______ g;
(2)实验过程中,所加盐酸在第_______ 次时碳酸钙已经完全反应;
(3)产品中碳酸钙的质量______ g;碳酸钙的质量分数______ ;该产品________ (填“合格”或“不合格”)。
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 反应后烧杯及所盛物质的总质量/g | 191.2 | 214.4 | 238.6 | 263.6 |
(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是
(2)实验过程中,所加盐酸在第
(3)产品中碳酸钙的质量
2018·四川广安·三模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网