科学探究题 较难0.4 引用2 组卷293
小明在做铁与硫酸溶液反应的实验时,发现生成的气体有刺激性气味,于是进行了探究.
【提出问题】铁与硫酸溶液反应生成的气体为什么有刺激性气味?
【查阅资料】
(1)6H2SO4(浓)+2Fe Fe2(SO4)3+6H2O+3SO2↑
Fe2(SO4)3+6H2O+3SO2↑
(2)SO2可使品红溶液的红色褪去
【进行猜想】铁与不同浓度的硫酸溶液反应,生成的气体产生可能有二氧化硫
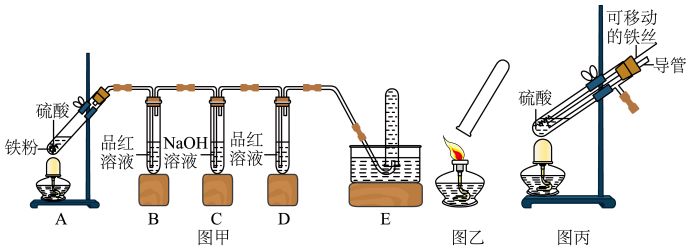
【实验探究】小明用图甲所示装置进行实验,并将E中收集到的气体进行如图乙所示的爆鸣实验.
(1)请帮助小明完成下表:
【实验结论】铁与不同浓度的硫酸反应,生成的气体产物可能不同,当硫酸溶液浓度达到足够大时,生成的气体产物中有二氧化硫.
(2)【实验结论】铁与不同浓度的硫酸反应,生成的气体产物可能不同,当硫酸溶液浓度达到足够大时,生成的气体产物中有二氧化硫
【交流反思】
(1)写出实验三中铁与硫酸溶液反应的化学方程式________ ,写出实验二中发生爆鸣反应的化学方程式________ .
(2)实验一中C装置的作用是________ .
【拓展延伸】小明又将A装置进行了如图所示的改进,试分析:增加的导管下端伸入液面以下原因________ ,该导管所起的作用是_________ .

【提出问题】铁与硫酸溶液反应生成的气体为什么有刺激性气味?
【查阅资料】
(1)6H2SO4(浓)+2Fe
 Fe2(SO4)3+6H2O+3SO2↑
Fe2(SO4)3+6H2O+3SO2↑(2)SO2可使品红溶液的红色褪去
【进行猜想】铁与不同浓度的硫酸溶液反应,生成的气体产生可能有二氧化硫
【实验探究】小明用图甲所示装置进行实验,并将E中收集到的气体进行如图乙所示的爆鸣实验.
(1)请帮助小明完成下表:
| 实验现象 | A中生成气体成分 | ||||
| B中品红溶液 | D中品红溶液 | 爆鸣实验 | |||
| 实验一 | 98% | 不褪色 | 无爆鸣声 | 只有SO2 | |
| 实验二 | 45% | 稍有褪色 | 不褪色 | 有爆鸣声 | |
| 实验三 | 25% | 不褪色 | 只有H2 | ||
(2)【实验结论】铁与不同浓度的硫酸反应,生成的气体产物可能不同,当硫酸溶液浓度达到足够大时,生成的气体产物中有二氧化硫
【交流反思】
(1)写出实验三中铁与硫酸溶液反应的化学方程式
(2)实验一中C装置的作用是
【拓展延伸】小明又将A装置进行了如图所示的改进,试分析:增加的导管下端伸入液面以下原因
2018·安徽滁州·一模
类题推荐
在抗击新冠肺炎疫情的战役中,84消毒液和维生素C等相关药物均发挥重要作用。查阅资料:“84消毒液”有效成分为次氯酸钠(NaClO);维生素C泡腾片主要含有维生素C以及配料酒石酸和碳酸氢钠。
Ⅰ、工业上次氯酸钠和碳酸氢钠均能以食盐为原料制得,其工业流程如图1所示:
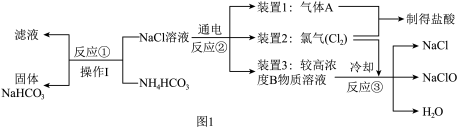
(1)收集气体A装置1必须保证气密性良好并在其周围严禁明火,其原因是______ (用化学方程式表示)。
(2)反应①化学方程式为______ ,反应③化学方程式为______ 。
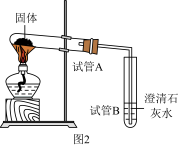
Ⅱ、烘焙材料中也有碳酸氢钠,将碳酸氢钠放入图2装置中进行实验。对试管A中碳酸氢钠固体充分加热,出现的现象有:①试管A管口发现有小水珠;②试管B溶液中出现的现象有______ ;③试管A中有白色固体剩余。探究剩余白色固体成分。
查阅相关资料:①钠具有银白色金属光泽;②氧化钠为白色固体且溶于水能生成氢氧化钠,过氧化钠为淡黄色固体。
【提出猜想】猜想①:氧化钠;猜想②:氢氧化钠;猜想③:______ ;猜想④:氧化钠和氢氧化钠………
【实验验证】取充分加热后试管A中的白色固体于烧杯中,加入少量的水溶解得溶液,进行以下实验:
【实验反思】烘焙中加入碳酸氢钠的作用:①防止面粉发酵酸性过强,做抗酸剂;②加热时做______ 。
Ⅰ、工业上次氯酸钠和碳酸氢钠均能以食盐为原料制得,其工业流程如图1所示:


(1)收集气体A装置1必须保证气密性良好并在其周围严禁明火,其原因是
(2)反应①化学方程式为
Ⅱ、烘焙材料中也有碳酸氢钠,将碳酸氢钠放入图2装置中进行实验。对试管A中碳酸氢钠固体充分加热,出现的现象有:①试管A管口发现有小水珠;②试管B溶液中出现的现象有
查阅相关资料:①钠具有银白色金属光泽;②氧化钠为白色固体且溶于水能生成氢氧化钠,过氧化钠为淡黄色固体。
【提出猜想】猜想①:氧化钠;猜想②:氢氧化钠;猜想③:
【实验验证】取充分加热后试管A中的白色固体于烧杯中,加入少量的水溶解得溶液,进行以下实验:
| 实验内容 | 实验现象 | 实验结论 | |
| 步骤1 | 滴加少量 | 猜想③成立 | |
| 步骤2 | 加入 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网