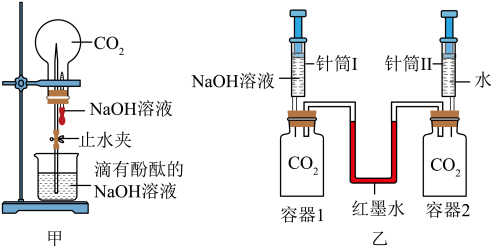
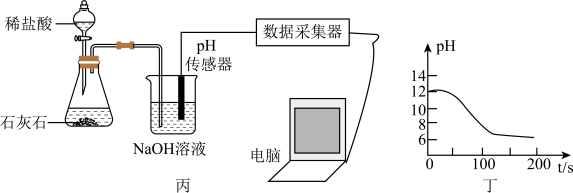
综合应用题 较难0.4 引用2 组卷151
某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究。
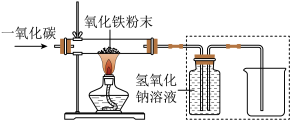
【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】
① CO还原Fe2O3的固体产物的成分与反应温度、反应时间等因素有关
② CO还原Fe2O3的实验过程中固体产物可能有Fe3O4、FeO、Fe
③ NaOH溶液与石灰水相似,能吸收CO2,但不变浑浊
④
【实验与猜想】
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有________ 和 ________
(2)进行猜想:黑色固体粉末可能a.全部为铁粉;b.__________ ;c._________
【得出结论】
(3)通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称)________ 。
【反思与评价】
(4)一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度。
(5)实验装置图中采用虚线框内的装置,其作用有________ 。
A.收集CO B.吸收CO2 C.检验CO2
【实践应用】小明和他的同学想测定某赤铁矿石中Fe2O3的质量分数。用CO与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用足量的NaOH溶液完全吸收,该溶液总质量与反应时间的变化关系如右图。
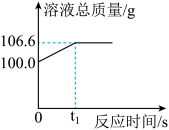
(6)上述反应产生CO2的质量为_______ g;
(7)计算该赤铁矿石中氧化铁的质量分数为___________ 。(需要有计算过程)

【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】
① CO还原Fe2O3的固体产物的成分与反应温度、反应时间等因素有关
② CO还原Fe2O3的实验过程中固体产物可能有Fe3O4、FeO、Fe
③ NaOH溶液与石灰水相似,能吸收CO2,但不变浑浊
④
| 物质性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有
(2)进行猜想:黑色固体粉末可能a.全部为铁粉;b.
【得出结论】
(3)通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称)
【反思与评价】
(4)一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度。
(5)实验装置图中采用虚线框内的装置,其作用有
A.收集CO B.吸收CO2 C.检验CO2
【实践应用】小明和他的同学想测定某赤铁矿石中Fe2O3的质量分数。用CO与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用足量的NaOH溶液完全吸收,该溶液总质量与反应时间的变化关系如右图。

(6)上述反应产生CO2的质量为
(7)计算该赤铁矿石中氧化铁的质量分数为
17-18九年级上·江苏扬州·阶段练习
类题推荐
烧碱和纯碱与人类日常生活、工农业生产及科研活动关系十分密切。
(1)配制50g溶质质量分数为2%的NaOH溶液,下列操作会造成溶质质量分数偏大的是__________ (填序号)。
①固体放在托盘天平的右盘称量
②量取水时俯视刻度线读数
③将配好的溶液装瓶时洒出一部分
(2)分别测定25℃时溶质质量分数为1%、2%、4%的Na2CO3溶液的pH,记录数据如下:
①分析三组数据可得出的结论是__________ 。
②将50g溶质质量分数为4%的Na2CO3溶液稀释到1%,需要加入水的质量是__________ g。
(3)工业上常用电解纯净的饱和食盐水来制烧碱,但是原料往往不能全部转化;另外,如果固体烧碱长时间在仓库放置,表面可能会有Na2CO3杂质生成。
①现从仓库中取来烧碱样品,推测该烧碱样品中除可能含Na2CO3外还可能含有另一种杂质。要检测样品中可能含有的这两种杂质,请完成下列实验方案:
②某同学提出a中的稀HNO3也可改用稀HCl,你认为他的看法__________ (填“合理”或“不合理”)原因是__________ 。
(4)取某食用纯碱样品10g,加入一定量稀盐酸恰好完全反应(假设杂质不参与反应),同时产生了2.2g气体。试计算该食用纯碱中碳酸钠的质量分数。__________
(1)配制50g溶质质量分数为2%的NaOH溶液,下列操作会造成溶质质量分数偏大的是
①固体放在托盘天平的右盘称量
②量取水时俯视刻度线读数
③将配好的溶液装瓶时洒出一部分
(2)分别测定25℃时溶质质量分数为1%、2%、4%的Na2CO3溶液的pH,记录数据如下:
| 溶质质量分数 | 1% | 2% | 4% |
| 溶液pH | 11.62 | 11.76 | 11.90 |
①分析三组数据可得出的结论是
②将50g溶质质量分数为4%的Na2CO3溶液稀释到1%,需要加入水的质量是
(3)工业上常用电解纯净的饱和食盐水来制烧碱,但是原料往往不能全部转化;另外,如果固体烧碱长时间在仓库放置,表面可能会有Na2CO3杂质生成。
①现从仓库中取来烧碱样品,推测该烧碱样品中除可能含Na2CO3外还可能含有另一种杂质。要检测样品中可能含有的这两种杂质,请完成下列实验方案:
| 实验步骤 | 实验现象 | 结论 |
| a.取少量样品于试管中并加入过量的稀HNO3 | 有气泡 | 存在Na2CO3 |
| b. | 生成白色沉淀 |
②某同学提出a中的稀HNO3也可改用稀HCl,你认为他的看法
(4)取某食用纯碱样品10g,加入一定量稀盐酸恰好完全反应(假设杂质不参与反应),同时产生了2.2g气体。试计算该食用纯碱中碳酸钠的质量分数。
化学知识能够破解某些骗局,骗子常用金光闪闪的“假金元宝”(Cu-Zn合金制成)冒充真金,蒙骗贪小便宜之人,“圳创”小组进行了真假元宝的鉴别。
(1)定性鉴别。下列方法中不能检验金元宝真假的是_______________________ (填字母,可多选);
A 观察外观 B 检测其密度
C 放入MgCl2溶液中 D 在空气中加热
(2)定量测定。取40g“假金元宝”样品,磨成粉末放入烧杯,将150g一定浓度的稀硫酸分3次加入烧杯中,每次充分反应后,测得剩余固体的质量记录如下表。
①第二次实验后剩余29.6g固体的成分是___________ (填字母);
A Cu B Zn C Cu和Zn
②样品中Cu的质量分数为_______________ %;
③反应一共生成H2的质量是多少?(写出详细计算过程)____
④请在下图中绘制出“产生H2的质量”跟“加入稀硫酸的质量”的关系图像。____
(1)定性鉴别。下列方法中不能检验金元宝真假的是
A 观察外观 B 检测其密度
C 放入MgCl2溶液中 D 在空气中加热
(2)定量测定。取40g“假金元宝”样品,磨成粉末放入烧杯,将150g一定浓度的稀硫酸分3次加入烧杯中,每次充分反应后,测得剩余固体的质量记录如下表。
| 次数 | 1 | 2 | 3 |
| 加入稀硫酸质量/g | 50 | 50 | 50 |
| 剩余固体质量/g | 34.8 | 29.6 | 27.0 |
A Cu B Zn C Cu和Zn
②样品中Cu的质量分数为
③反应一共生成H2的质量是多少?(写出详细计算过程)
④请在下图中绘制出“产生H2的质量”跟“加入稀硫酸的质量”的关系图像。

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网