科学探究题 困难0.15 引用1 组卷518
鸡蛋主要由蛋壳、蛋壳膜、蛋白、蛋黄等几个部分组成,其中蛋壳的主要成分是CaCO3,里面覆盖一层蛋壳膜。我校兴趣小组的同学为此开展了以下探究活动:
【提出问题1】
(1)鸡蛋白中含有的营养成分是_________________ 。
【查阅资料】
a.蛋壳是经过自然形成。科学手段检测蛋壳中含CaCO3约82%—85%,蛋白质15%—17%,并含多种微量元素;
b.蛋壳膜中蛋白质约占90%—93%。
【提出问题2】
蛋壳中的CaCO3含量是多少呢?小华拟将该蛋壳放在空气中充分灼烧完成测定;小明拟通过蛋壳与稀盐酸反应完成测定。请你参与他们的探究。
【设计方案】他们分别称取12.0 g蛋壳设计了以下不同的实验方案:
(2)小华的方案:
称取12.0 g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16g。则:产生的CO2质量__________ g,蛋壳中的CaCO3的质量分数为________ %(结果保留到小数点后一位)。
(3)小明的方案:小明设计了如下图所示的实验装置。(已知其他成分均不与稀盐酸反应,装置内试剂均足量)
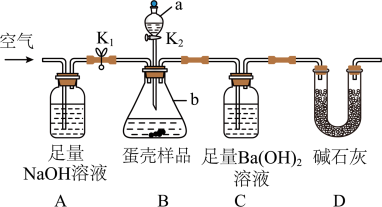
【实验步骤】
① 出编号仪器的名称:a___________ ,b__________ ;
② 按上图连接好装置后,并________________ ;
③ 向B装置中加入蛋壳样品后,先通入空气一会儿;
④__________ K1,_________ K2(填“打开”或“关闭”),向蛋壳样品中滴入10%的盐酸,直到B中___________________ 为止(填实验现象);
⑤ 再通入一会儿空气,目的是___________________ ;
⑥ 将装置C中的固液混合物过滤、洗涤、干燥后称量其质量;
⑦ 重复上述实验。
【实验数据】重复实验,3次数据记录如下:
【实验分析及数据处理】
① 上述数据能否用托盘天平称量_______________ 。(填“能”或“不能”)
② 若无A装置,直接通入空气,则测定结果将___________ 。(填“偏大”、“偏小”或“不变”)
③ 实验重复3次的目的是____________________ 。
④ 请利用3次实验数据的平均值,计算该蛋壳中的CaCO3含量____________ (已知:BaCO3相对分子量为197,结果保留到小数点后一位)。(请写出具体的计算过程,该空2分)
【实验反思】
(1)下列各项措施中,能提高小明测定准确度的是____________________ (填字母序号)。
A.在装置A、B之间增加盛有浓硫酸的洗气瓶
B.缓缓滴加稀盐酸
C.在装置B、C之间增加盛有饱和NaHCO3的洗气瓶
(2)大家讨论后,一致认为小明的方案更合理,你认为小华方案存在较大误差的原因主要是______________ 。

【提出问题1】
(1)鸡蛋白中含有的营养成分是
【查阅资料】
a.蛋壳是经过自然形成。科学手段检测蛋壳中含CaCO3约82%—85%,蛋白质15%—17%,并含多种微量元素;
b.蛋壳膜中蛋白质约占90%—93%。
【提出问题2】
蛋壳中的CaCO3含量是多少呢?小华拟将该蛋壳放在空气中充分灼烧完成测定;小明拟通过蛋壳与稀盐酸反应完成测定。请你参与他们的探究。
【设计方案】他们分别称取12.0 g蛋壳设计了以下不同的实验方案:
(2)小华的方案:
称取12.0 g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16g。则:产生的CO2质量
(3)小明的方案:小明设计了如下图所示的实验装置。(已知其他成分均不与稀盐酸反应,装置内试剂均足量)

【实验步骤】
① 出编号仪器的名称:a
② 按上图连接好装置后,并
③ 向B装置中加入蛋壳样品后,先通入空气一会儿;
④
⑤ 再通入一会儿空气,目的是
⑥ 将装置C中的固液混合物过滤、洗涤、干燥后称量其质量;
⑦ 重复上述实验。
【实验数据】重复实验,3次数据记录如下:
| 实验次数 | 实验1 | 实验2 | 实验3 |
| 装置C中沉淀质量(g) | 19.68 | 19.75 | 19.67 |
【实验分析及数据处理】
① 上述数据能否用托盘天平称量
② 若无A装置,直接通入空气,则测定结果将
③ 实验重复3次的目的是
④ 请利用3次实验数据的平均值,计算该蛋壳中的CaCO3含量
【实验反思】
(1)下列各项措施中,能提高小明测定准确度的是
A.在装置A、B之间增加盛有浓硫酸的洗气瓶
B.缓缓滴加稀盐酸
C.在装置B、C之间增加盛有饱和NaHCO3的洗气瓶
(2)大家讨论后,一致认为小明的方案更合理,你认为小华方案存在较大误差的原因主要是
16-17九年级下·江苏扬州·阶段练习
类题推荐
碳酸钠广泛用于造纸、纺织、制革等工业,是一种重要的化工原料。我国侯德榜发明了将制碱与制氨结合起来的联合制碱法,为碳酸钠的工业化生产作出了巨大贡献。
【查阅资料】侯氏制碱法中主要反应:
Ⅰ.NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
Ⅱ.2NaHCO3=Na2CO3+H2O+CO2↑
【实验探究】小明以粗盐配制饱和食盐水,并采用如图1所示装置模拟制备碳酸氢钠,进而制得碳酸钠。
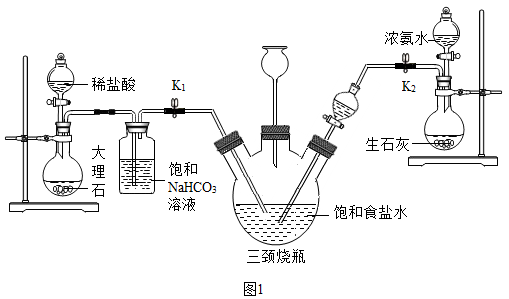
实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。请回答下列问题:
(1)粗盐中除了含有泥沙等不溶性杂质,还含有少量的MgCl2等。若要除去粗盐中的MgCl2,可加入过量的NaOH溶液,写出对应的化学方程式 ______ ,再过滤,然后向滤液中加入适量 ______ ,得到氯化钠溶液。
(2)饱和 NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为______ 。
(3)三颈烧瓶上连接的长颈漏斗的主要作用是______ ,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是 ______ ;关闭K2停止通NH3后,还要继续通一段时间CO2,其目的是 ______ 。
(4)根据实验记录,计算t2时 NaHCO3固体的分解率(已分解的 NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程_____ 。
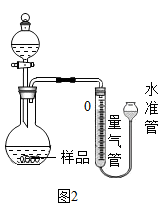
【拓展延伸】小华设计如图2的实验装置测定某纯碱样品 (含少量杂质NaCl)中碳酸钠的质量分数:取一定量的样品与足量稀硫酸反应,通过排饱和碳酸氢钠溶液测定生成CO2的体积,计算样品中碳酸钠的质量分数。(已知常温常压下CO2的密度是1.977g/L)
(1)如果样品质量为5.3g,则实验中选用的量气管规格最合适的是______ (填字母)。
A.500mL B.1000mL C.1500mL D.2000mL
(2)若实验中测得碳酸钠质量分数偏小,下列可能的原因是______ 。
a.装置漏气
b.读取数据时量气管的液面低于水准管的液面
c.反应结束后烧瓶中有CO2残留
d.读取数据时仰视读数
e.稀硫酸加入烧瓶占据体积
【查阅资料】侯氏制碱法中主要反应:
Ⅰ.NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
Ⅱ.2NaHCO3=Na2CO3+H2O+CO2↑
【实验探究】小明以粗盐配制饱和食盐水,并采用如图1所示装置模拟制备碳酸氢钠,进而制得碳酸钠。


实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。请回答下列问题:
| 加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
| 剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
(2)饱和 NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为
(3)三颈烧瓶上连接的长颈漏斗的主要作用是
(4)根据实验记录,计算t2时 NaHCO3固体的分解率(已分解的 NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程
【拓展延伸】小华设计如图2的实验装置测定某纯碱样品 (含少量杂质NaCl)中碳酸钠的质量分数:取一定量的样品与足量稀硫酸反应,通过排饱和碳酸氢钠溶液测定生成CO2的体积,计算样品中碳酸钠的质量分数。(已知常温常压下CO2的密度是1.977g/L)
(1)如果样品质量为5.3g,则实验中选用的量气管规格最合适的是
A.500mL B.1000mL C.1500mL D.2000mL
(2)若实验中测得碳酸钠质量分数偏小,下列可能的原因是
a.装置漏气
b.读取数据时量气管的液面低于水准管的液面
c.反应结束后烧瓶中有CO2残留
d.读取数据时仰视读数
e.稀硫酸加入烧瓶占据体积
碳酸氢钠(NaHCO3)是一种重要的化工原料。某化学兴趣小组同学对碳酸氢钠的性质进行探究。
【查阅资料】
①碳酸氢钠的溶解度如下:
②碳酸氢钠固体在潮湿的空气中久置或受热分解均生成Na2CO3、H2O和CO2。
【实验探究】
探究1:NaHCO3溶液与盐酸反应的热效应
室温下(20℃),边搅拌边向盛有0.5gNaHCO3固体的烧杯中加入10mL水,测得温度为18.5℃;恢复至室温后,向烧杯中加入过量10mL质量分数为20%的盐酸(20℃),搅拌,测得温度为20.8℃。
(1)实验中配制的NaHCO3溶液___________ (填“是”或“不是”)饱和溶液。
(2)由上述实验可知:NaHCO3固体溶于水___________ (填“放热”或“吸热”)。有同学认为由上述实验得出NaHCO3溶液与盐酸反应放热的结论并不可靠,理由是___________ 。
探究2:NaHCO3溶液与CaCl2溶液的反应
分别向10mL0.5%和5%NaHCO3溶液中滴加10%的CaCl2溶液,发现均有白色浑浊出现,通过传感器测得CO2浓度与时间的关系如图1、2所示。
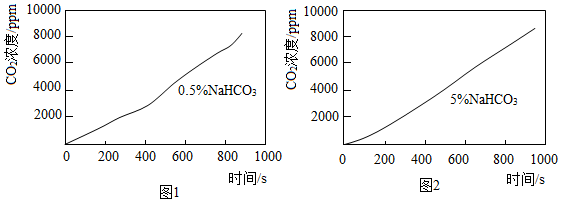
(3)由上图得出的实验结论是___________ 。
(4)该条件下,NaHCO3溶液和CaCl2溶液反应的化学方程式为:2NaHCO3+CaCl2═2NaCl+___________ +H2O。
探究3:久置的NaHCO3样品中NaHCO3含量的测定
将一瓶在潮湿空气中久置的NaHCO3样品(假设只有NaHCO3和Na2CO3)混合均匀后,称取190g混合物,加热至恒重,称其质量为159g。
(5)①计算样品中NaHCO3的质量分数________ (结果精确至0.01%)。
②若上述测定过程中未加热至恒重,则测得NaHCO3的质量分数将___________ (填“偏大”、“偏小”或“无影响”)。
【查阅资料】
①碳酸氢钠的溶解度如下:
| 温度 | 10℃ | 20℃ | 30℃ | 40℃ |
| 溶解度 | 8.1g | 9.6g | 11.1g | 12.7g |
②碳酸氢钠固体在潮湿的空气中久置或受热分解均生成Na2CO3、H2O和CO2。
【实验探究】
探究1:NaHCO3溶液与盐酸反应的热效应
室温下(20℃),边搅拌边向盛有0.5gNaHCO3固体的烧杯中加入10mL水,测得温度为18.5℃;恢复至室温后,向烧杯中加入过量10mL质量分数为20%的盐酸(20℃),搅拌,测得温度为20.8℃。
(1)实验中配制的NaHCO3溶液
(2)由上述实验可知:NaHCO3固体溶于水
探究2:NaHCO3溶液与CaCl2溶液的反应
分别向10mL0.5%和5%NaHCO3溶液中滴加10%的CaCl2溶液,发现均有白色浑浊出现,通过传感器测得CO2浓度与时间的关系如图1、2所示。

(3)由上图得出的实验结论是
(4)该条件下,NaHCO3溶液和CaCl2溶液反应的化学方程式为:2NaHCO3+CaCl2═2NaCl+
探究3:久置的NaHCO3样品中NaHCO3含量的测定
将一瓶在潮湿空气中久置的NaHCO3样品(假设只有NaHCO3和Na2CO3)混合均匀后,称取190g混合物,加热至恒重,称其质量为159g。
(5)①计算样品中NaHCO3的质量分数
②若上述测定过程中未加热至恒重,则测得NaHCO3的质量分数将
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网