实验题 较难0.4 引用1 组卷261
工业生产的纯碱中常含有少量氯化钠杂质,下列装置是测定纯碱在该混合物中质量分数的实验方法之一。(碱石灰为CaO和NaOH的固体混合物)
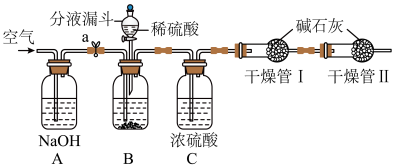
①检查装置气密性;
②称量干燥管 I及其干燥剂的总质量为100g;
③将称量好的纯碱样品 12g放入广口瓶 B 中,关闭分液漏斗旋塞;
④在未连接干燥装置之前先通入空气几分钟,然后关闭开关 a,再连接好干燥装置;
⑤从分液漏斗中缓慢加入稀硫酸至不再产生气泡,关闭分液漏斗旋塞:
⑥打开开关a,缓慢鼓入空气几分钟后,再称量干燥管 I的质量为104.4g.
(1)最初鼓入空气的目的是排除装置A、B、C 中的空气,防止测定结果________ (填“偏大”、“偏小”)。
(2)装置C的作用是______________ 。
(3)装置A中一定发生的反应方程式为___________________ 。
(4)装置B中发生的反应方程式为_______________________ 。
(5)纯碱样品中碳酸钠的质量分数是________ (结果精确到0.1%)。

①检查装置气密性;
②称量干燥管 I及其干燥剂的总质量为100g;
③将称量好的纯碱样品 12g放入广口瓶 B 中,关闭分液漏斗旋塞;
④在未连接干燥装置之前先通入空气几分钟,然后关闭开关 a,再连接好干燥装置;
⑤从分液漏斗中缓慢加入稀硫酸至不再产生气泡,关闭分液漏斗旋塞:
⑥打开开关a,缓慢鼓入空气几分钟后,再称量干燥管 I的质量为104.4g.
(1)最初鼓入空气的目的是排除装置A、B、C 中的空气,防止测定结果
(2)装置C的作用是
(3)装置A中一定发生的反应方程式为
(4)装置B中发生的反应方程式为
(5)纯碱样品中碳酸钠的质量分数是
14-15九年级下·山西·阶段练习
类题推荐
暖贴发热是利用了铁粉生锈放出热量的原理,某小组同学设计并进行下列实验,探究铁生锈的条件及影响铁粉生锈速率的因素。
Ⅰ、探究铁生锈的条件
【设计实验】取3段光亮无锈的细铁丝,绕成螺旋状,进行如图所示的三个实验,实验要保证有足够长的时间来观察现象。
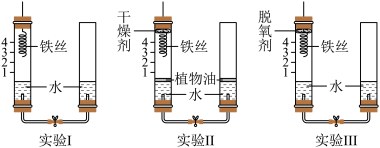
(1)对比实验________________ (填序号),可以得出铁生锈需要水。
(2)实验I中铁丝足量,时间足够长,打开止水夹后,观察到现象_____________ 。
Ⅱ、探究影响铁粉生锈速率的因素
【查阅资料】暖贴的发热材料主要有铁粉、活性炭、食盐、水等物质。
【猜想假设】①活性炭能加快铁粉生锈的速率。 ②食盐能加快铁粉生锈的速率。
【进行实验】下表是2g铁粉、5g水与不同质量活性炭、食盐混合均匀10分钟温度记录。
【解释与结论】
(3)上表中x的值为___________ 。
(4)对比实验1和3,得出的结论是_____________ 。
(5)欲得出结论“活性炭与食盐同时存在会大幅度加快生锈速率”,需要对比1和__________ (填实验编号)。
【反思与评价】
(6)下列说法或做法正确的是_____ (填字母)。
a.暖贴在使用前不需要密封保存
b.利用铁生锈的原理,可以测定空气中氧气含量
c.利用铁生锈的原理,铁粉还可用于食品保鲜
d.校内用钢架制作的自行车防雨棚应定期喷涂油漆防锈
【拓展延伸】
可以利用稀硫酸清除铁制品表面的锈,其原理是(化学方程式)__________ .但除锈时不可以将铁制品长时间浸在酸中,因为(化学方程式)____________ .
Ⅰ、探究铁生锈的条件
【设计实验】取3段光亮无锈的细铁丝,绕成螺旋状,进行如图所示的三个实验,实验要保证有足够长的时间来观察现象。

(1)对比实验
(2)实验I中铁丝足量,时间足够长,打开止水夹后,观察到现象
Ⅱ、探究影响铁粉生锈速率的因素
【查阅资料】暖贴的发热材料主要有铁粉、活性炭、食盐、水等物质。
【猜想假设】①活性炭能加快铁粉生锈的速率。 ②食盐能加快铁粉生锈的速率。
【进行实验】下表是2g铁粉、5g水与不同质量活性炭、食盐混合均匀10分钟温度记录。
| 实验编号 | 活性炭/g | 食盐/g | 温度上升值/℃ |
| 1 | 0 | 0 | 0.1 |
| 2 | 0.2 | 0 | 22.0 |
| 3 | 0 | x | 3.1 |
| 4 | 0.2 | 0.2 | 56.3 |
(3)上表中x的值为
(4)对比实验1和3,得出的结论是
(5)欲得出结论“活性炭与食盐同时存在会大幅度加快生锈速率”,需要对比1和
【反思与评价】
(6)下列说法或做法正确的是
a.暖贴在使用前不需要密封保存
b.利用铁生锈的原理,可以测定空气中氧气含量
c.利用铁生锈的原理,铁粉还可用于食品保鲜
d.校内用钢架制作的自行车防雨棚应定期喷涂油漆防锈
【拓展延伸】
可以利用稀硫酸清除铁制品表面的锈,其原理是(化学方程式)
对金属材料的研究,在人类发展的历史长河中起着非常重要的作用。请回答下列问题。
(1)金属的获得。下表给出了某些金属的信息。
①依据表中信息解释,金和铂均很昂贵的原因是_______ 。
②工业上用含铝矿石制取铝。将熔融的氧化铝通电分解,可获得铝和另一种单质。反应的化学方程式_______ 。铝抗腐蚀性强的原因是_______ 。
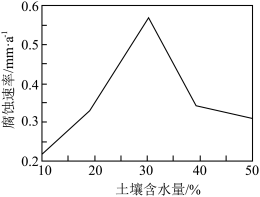
(2)金属的锈蚀和保护。长期埋在地下的金属导线会被腐蚀。常温下,某金属管线腐蚀速率与土壤含水量的关系如下图所示。分析下图得出的结论是_______ 。
(3)金属的应用。同学们用图1所示装置(装置气密性良好)对暖宝宝发热过程进行研究,传感器获得图2和图3所示的实验数据。已知暖宝宝工作原理是利用铁粉生锈发热。回答下列问题:

①由图2得出的结论是_______ 。
②图3气压没有明显变化的原因是_______ 。
(4)不锈钢是铁、铬(Cr)、镍(Ni)的合金,常用来制造医疗器械、餐具等。通过实验得知,铬和镍两种金属都能与稀硫酸反应生成氢气,分别得到硫酸铬(SrSO4)和硫酸镍(NiSO4)溶液。请写出铬(Cr)与稀硫酸反应的化学方程式_______ 。
(5)铁生锈的主要过程为:

I.写出转化①的化学方程式_______ 。
II.转化③生成Fe2O3·xH2O,则x<_______ (x为整数)。
(6)生铁和钢都是铁和碳的合金,生铁含碳量为2%-4.3%,钢含碳量为0.03%-2%。化学兴趣小组的同学为确定某铁合金是生铁还是钢,它们取11.5g铁合金样品盛放到锥形瓶中,将100g稀盐酸分成5等份,分5次加入锥形瓶,每次待充分反应后记录实验数据。实验数据整理如下表所示:
查阅资料:碳不与稀盐酸反应。
请回答下列问题:
①根据质量守恒定律,该反应中生成气体的总质量为_______ 。
②实验数据表中m的值为_______ 。
③请通过计算确定含铁合金是生铁还是钢(在答题卡上写出计算过程,计算结果保留到0.1%)。_______
(1)金属的获得。下表给出了某些金属的信息。
| 每吨金属在2018年12月的价格(元) | 地壳中的含量(%) | |
| 铝 | 13586 | 7.73 |
| 铂 | 305 000 000 | 0.000 000 1 |
| 金 | 339 000 000 | 0.000 0001 |
②工业上用含铝矿石制取铝。将熔融的氧化铝通电分解,可获得铝和另一种单质。反应的化学方程式
(2)金属的锈蚀和保护。长期埋在地下的金属导线会被腐蚀。常温下,某金属管线腐蚀速率与土壤含水量的关系如下图所示。分析下图得出的结论是

(3)金属的应用。同学们用图1所示装置(装置气密性良好)对暖宝宝发热过程进行研究,传感器获得图2和图3所示的实验数据。已知暖宝宝工作原理是利用铁粉生锈发热。回答下列问题:

①由图2得出的结论是
②图3气压没有明显变化的原因是
(4)不锈钢是铁、铬(Cr)、镍(Ni)的合金,常用来制造医疗器械、餐具等。通过实验得知,铬和镍两种金属都能与稀硫酸反应生成氢气,分别得到硫酸铬(SrSO4)和硫酸镍(NiSO4)溶液。请写出铬(Cr)与稀硫酸反应的化学方程式
(5)铁生锈的主要过程为:

I.写出转化①的化学方程式
II.转化③生成Fe2O3·xH2O,则x<
(6)生铁和钢都是铁和碳的合金,生铁含碳量为2%-4.3%,钢含碳量为0.03%-2%。化学兴趣小组的同学为确定某铁合金是生铁还是钢,它们取11.5g铁合金样品盛放到锥形瓶中,将100g稀盐酸分成5等份,分5次加入锥形瓶,每次待充分反应后记录实验数据。实验数据整理如下表所示:
| 次数 | 加盐酸前 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 加入稀盐酸的质量(g) | 0 | 20 | 20 | 20 | 20 | 20 |
| 锥形瓶内物质的总质量(g) | 11.5 | 31.4 | m | 71.2 | 91.1 | 111.1 |
请回答下列问题:
①根据质量守恒定律,该反应中生成气体的总质量为
②实验数据表中m的值为
③请通过计算确定含铁合金是生铁还是钢(在答题卡上写出计算过程,计算结果保留到0.1%)。
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



