科学探究题 较难0.4 引用1 组卷178
有学者提出“铁丝燃烧绕成螺旋状,是为了防止燃烧点因迅速上升到集气瓶内氧气低浓度区而熄灭”。据此,化学学习小组的同学决定对铁丝在氧气中燃烧进行更深入的探究。
活动一:探究铁丝燃烧时长的影响因素
[实验1]如图1所示,从同一长铁丝上分别截取3根长度相同的铁丝,将1根拉直、另2根绕成直径大小不同的螺旋状,下端系上燃着的小木条进行燃烧实验。每种形状的铁丝平行测量3次,所测得的实验数据如图2所示。______ ,故进行该实验时,宜选择容积为______ (填“125”或“250”)mL的集气瓶更容易成功。
(2)实验中发现不管铁丝形状如何,其燃烧时长均在曲线附近,说明燃烧时长与铁丝是否绕成螺旋状_____ (填“有关”或“无关”)。
(3)实验时,3根铁丝均要完全伸入集气瓶中,原因是______ 。
(4)分析图2可知,铁丝在氧气中剧烈燃烧的时长与集气瓶内氧气的起始浓度的关系是_______ 。
活动二:探究铁丝的含碳量与火星四射的关系
[实验2]取粗细相同、含碳量不同的细铁丝,分别在氧气中燃烧,记录实验现象如表。
(5)实验中_______ (填“能”或“不能”)以产生火星四射的现象作为衡量铁丝是否燃烧的唯一标志。
反思与拓展
(6)理论上,铁丝燃烧后质量会增加。分析多组实验发现,铁丝未发生熔断,但反应前铁丝质量与反应后差别不大,其原因可能是________ 。
(7)冷烟花由多种金属粉末制成,燃放时火花飞舞,其喷射口处温度可高达700-800℃,火花喷出后温度迅速降低,距喷射口50mm处,温度降至约40℃,所以俗称冷烟花。燃放冷烟花的正确做法是_______ 。
活动一:探究铁丝燃烧时长的影响因素
[实验1]如图1所示,从同一长铁丝上分别截取3根长度相同的铁丝,将1根拉直、另2根绕成直径大小不同的螺旋状,下端系上燃着的小木条进行燃烧实验。每种形状的铁丝平行测量3次,所测得的实验数据如图2所示。
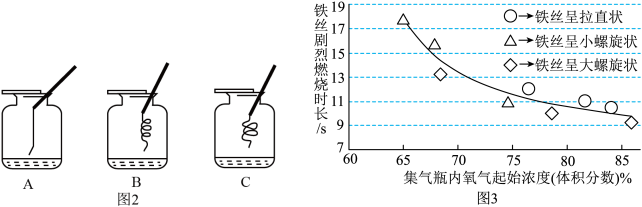
(2)实验中发现不管铁丝形状如何,其燃烧时长均在曲线附近,说明燃烧时长与铁丝是否绕成螺旋状
(3)实验时,3根铁丝均要完全伸入集气瓶中,原因是
(4)分析图2可知,铁丝在氧气中剧烈燃烧的时长与集气瓶内氧气的起始浓度的关系是
活动二:探究铁丝的含碳量与火星四射的关系
[实验2]取粗细相同、含碳量不同的细铁丝,分别在氧气中燃烧,记录实验现象如表。
| 铁丝含碳量 | 0% | 0.2% | 0.38% |
| 实验现象 | 无火星,燃烧处熔成小球 | 有短暂火星四射现象 | 火星四射,现象明显 |
(5)实验中
反思与拓展
(6)理论上,铁丝燃烧后质量会增加。分析多组实验发现,铁丝未发生熔断,但反应前铁丝质量与反应后差别不大,其原因可能是
(7)冷烟花由多种金属粉末制成,燃放时火花飞舞,其喷射口处温度可高达700-800℃,火花喷出后温度迅速降低,距喷射口50mm处,温度降至约40℃,所以俗称冷烟花。燃放冷烟花的正确做法是
2024·福建泉州·模拟预测
类题推荐
某品牌的“管道通”含有大量白色固体和少量银灰色固体,化学兴趣小组对此很好奇,于是展开如下探究:
【查阅资料】
①过碳酸钠 ,为白色结晶性粉末,加入水后,会产生碳酸钠和过氧化氢。
,为白色结晶性粉末,加入水后,会产生碳酸钠和过氧化氢。
②铝粉呈银灰色,铝与酸、强碱溶液都能反应放出氢气,同时放出大量热。
③氧气可以使酸性淀粉碘化钾溶液变蓝。
④暖宝贴粉末的主要成分为铁粉、氯化钠、活性炭。
【活动一】
(1)探究“管道通”中白色固体的主要成分
(2)小明对此结论提出质疑,理由是:______ 。
(3)为进一步验证小明的理由是否成立,小组同学提出向步骤2所得的溶液中加入氯化钡溶液,观察到产生白色沉淀,从而验证了小明的分析。写出产生白色沉淀的化学方程式______ 。通过上述探究,得出白色固体的主要成分是氢氧化钠和过碳酸钠。
【活动二】探究“管道通”加水后产生气体的主要成分
猜想与假设:① ;②
;② ;③
;③ ;④
;④
(4)小华提出质疑,不可能是猜想④,理由是:______ 。
小组同学设计了下面这套实验装置进行探究:
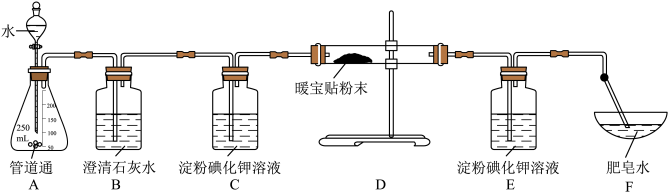
(5)现象:B中澄清石灰水不变浑浊,C中淀粉碘化钾溶液变蓝,E中淀粉碘化钾溶液不变蓝,F中肥皂泡上升,点燃气泡,有轻微的爆鸣声。得出结论:“管道通”加水后产生的气体是______ 。
(6)上述实验暖宝贴粉末的作用是:______ 。
(7)已知t℃时碳酸钠的溶解度为21.2g。将敞口一段时间的ag氢氧化钠和12.2g过碳酸钠的固体混合物完全溶解在一定量的水中,当温度恢复至t℃时,恰好形成含水100g的溶液123.2g,向该溶液加入碳酸钠固体,固体不能继续溶解,则该溶液中氢氧化钠溶质的质量为______ g,a的数值为______ 。
【查阅资料】
①过碳酸钠
②铝粉呈银灰色,铝与酸、强碱溶液都能反应放出氢气,同时放出大量热。
③氧气可以使酸性淀粉碘化钾溶液变蓝。
④暖宝贴粉末的主要成分为铁粉、氯化钠、活性炭。
【活动一】
(1)探究“管道通”中白色固体的主要成分
| 实验操作 | 实验现象 | 结论 |
| 1、将几粒白色颗粒放在玻璃片上,放置一会儿 | 白色颗粒潮湿并溶解 | 是氢氧化钠 |
| 2、将几粒白色颗粒放入盛有少量水的试管中,并用手触摸试管外壁 | 产生大量气泡 |
(2)小明对此结论提出质疑,理由是:
(3)为进一步验证小明的理由是否成立,小组同学提出向步骤2所得的溶液中加入氯化钡溶液,观察到产生白色沉淀,从而验证了小明的分析。写出产生白色沉淀的化学方程式
【活动二】探究“管道通”加水后产生气体的主要成分
猜想与假设:①
(4)小华提出质疑,不可能是猜想④,理由是:
小组同学设计了下面这套实验装置进行探究:

(5)现象:B中澄清石灰水不变浑浊,C中淀粉碘化钾溶液变蓝,E中淀粉碘化钾溶液不变蓝,F中肥皂泡上升,点燃气泡,有轻微的爆鸣声。得出结论:“管道通”加水后产生的气体是
(6)上述实验暖宝贴粉末的作用是:
(7)已知t℃时碳酸钠的溶解度为21.2g。将敞口一段时间的ag氢氧化钠和12.2g过碳酸钠的固体混合物完全溶解在一定量的水中,当温度恢复至t℃时,恰好形成含水100g的溶液123.2g,向该溶液加入碳酸钠固体,固体不能继续溶解,则该溶液中氢氧化钠溶质的质量为
以下是某老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
【提出问题】化学反应前后各物质的质量总和是否相等?
【查阅资料】氢氧化钠溶液可以吸收二氧化碳气体;稀盐酸与碳酸钠反应生成氯化钠、水和二氧化碳。
【猜想与假设】猜想1:不相等; 猜想2:相等。
【实验探究】甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
【反思评价】究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体逸出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在______ 中进行。
【优化装置】同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是______ (填序号),从另外两种装置中任选一种指出不足______ 。
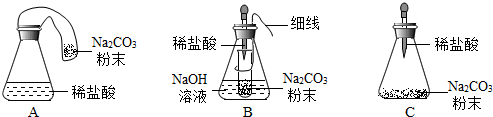
【得出结论】同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论:______ 的各物质的质量总和等于反应后生成的各物质的质量总和。
【解释应用】解释:在化学反应前后,原子的______ 、______ 、质量均不变,所以质量守恒。
【提出问题】化学反应前后各物质的质量总和是否相等?
【查阅资料】氢氧化钠溶液可以吸收二氧化碳气体;稀盐酸与碳酸钠反应生成氯化钠、水和二氧化碳。
【猜想与假设】猜想1:不相等; 猜想2:相等。
【实验探究】甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
| 甲组 | 乙组 | |
| 实验方案 (反应后略) |  |  |
| 实验现象 | 有气泡产生,天平指针向右偏转 | 有蓝色沉淀生成天平指针没有偏转 |
| 结论 | 猜想1正确 | 猜想2正确 |
【优化装置】同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是

【得出结论】同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论:
【解释应用】解释:在化学反应前后,原子的
为研究铝和铜的金属活动性,某研究小组进行如下探究。
(1)小明设计的实验方案是:将打磨的铝片和铜片分别放入稀盐酸中,观察反应的现象。写出铝与盐酸反应的化学方程式________ 。
(2)小芳将铝片放入氯化铜溶液中,看到有大量气泡逸出,且在一段时间内产生气泡越来越快,收集该气体可点燃,则生成的气体可能是__________ 。
(3)小芳在(2)实验中,还观察到铝片与浓氯化铜溶液反应时还有“白色沉淀”这一异常现象。
【提出问题】铝片与浓氯化铜溶液反应出现的白色沉淀的组成是什么?
【查阅文献】①AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。
②CuCl为白色固体,不溶于水、乙醇;溶于浓盐酸且溶液变蓝色。
【提出合理假设】假设a:该白色沉淀可能含有__________ ;
假设b:该白色沉淀可能含有AlCl3;
假设c:该白色沉淀可能含有Al。
【设计并完成实验】取白色沉淀分别进行如下实验:
【得出结论】实验①可判断假设 c_______ (填“成立”或“不成立”),再结合实验②和③可得出该白色沉淀的成分是_______________ 。
(4)室温时,小芳将等质量的相同铝片分别放入氯化铜溶液和硫酸铜溶液中,发现铝片和氯化铜溶液反应剧烈。
【发现问题】为什么铝片与氯化铜溶液反应比与硫酸铜溶液反应更剧烈呢?
【提出假设】①Cl-使铜盐和铝的反应容易进行。②__________ 。
【设计实验】为验证假设①是否正确,请设计一个合理的实验:___________ 。
(1)小明设计的实验方案是:将打磨的铝片和铜片分别放入稀盐酸中,观察反应的现象。写出铝与盐酸反应的化学方程式
(2)小芳将铝片放入氯化铜溶液中,看到有大量气泡逸出,且在一段时间内产生气泡越来越快,收集该气体可点燃,则生成的气体可能是
(3)小芳在(2)实验中,还观察到铝片与浓氯化铜溶液反应时还有“白色沉淀”这一异常现象。
【提出问题】铝片与浓氯化铜溶液反应出现的白色沉淀的组成是什么?
【查阅文献】①AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。
②CuCl为白色固体,不溶于水、乙醇;溶于浓盐酸且溶液变蓝色。
【提出合理假设】假设a:该白色沉淀可能含有
假设b:该白色沉淀可能含有AlCl3;
假设c:该白色沉淀可能含有Al。
【设计并完成实验】取白色沉淀分别进行如下实验:
| 实验编号 | 实验操作 | 实验现象 |
| ① | 加入适量浓盐酸 | 无气泡,固体溶解,得到褐色溶液 |
| ② | 加入适量无水乙醇 | 固体部分溶解 |
| ③ | 加入适量浓氨水 | 固体部分溶解,得到蓝色溶液 |
【得出结论】实验①可判断假设 c
(4)室温时,小芳将等质量的相同铝片分别放入氯化铜溶液和硫酸铜溶液中,发现铝片和氯化铜溶液反应剧烈。
【发现问题】为什么铝片与氯化铜溶液反应比与硫酸铜溶液反应更剧烈呢?
【提出假设】①Cl-使铜盐和铝的反应容易进行。②
【设计实验】为验证假设①是否正确,请设计一个合理的实验:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


