综合应用题 适中0.65 引用2 组卷48
化学就在我们身边,化学与生产、生活息息相关。
(1)生活中的下列做法不正确的是 (填字母)。
(2)正常雨水的pH约为5.6,其原因是_______ (用化学方程式表示)。
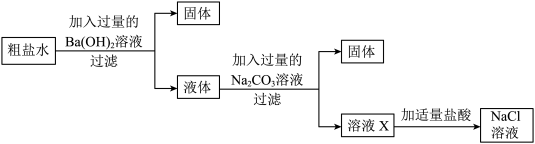
(3)氯化钠是生活中常见的盐。为除去氯化钠中的泥沙和( )杂质,某化学兴趣小组的同学先将粗盐样品溶解、过滤,除去泥沙后,取粗盐水按以下流程进行实验探究。
)杂质,某化学兴趣小组的同学先将粗盐样品溶解、过滤,除去泥沙后,取粗盐水按以下流程进行实验探究。_______ (写出两种)。
②加入 溶液时反应的化学方程式为
溶液时反应的化学方程式为_______ 。(提示:微溶物不形成沉淀)
③加入稀盐酸的作用是_______ 。
(4)下图为实验室模拟炼铁的实验装置。_______ 。
②已知集气瓶中盛放过量的氢氧化钠溶液,请设计实验证明实验后溶液中所含溶质的成分_______ 。(简要写出实验步骤、现象和结论)
(5)海水制“碱” v(Na2CO3)中含有少量的氯化钠。向盛有12g该“碱”样品的烧杯中加入足量的水充分溶解后,再加入过量的盐酸,充分反应后释放出二氧化碳4.4g。请计算该“碱”样品中碳酸钠质量分数是多少?(计算结果保留为0.1%)
(1)生活中的下列做法不正确的是 (填字母)。
| A.用甲醛溶液浸泡海鲜食品 |
| B.用洗涤剂除去餐具上的油污 |
| C.用食醋清洗水壶中的水垢 |
| D.用含碳酸氢钠的发酵粉焙制糕点 |
(2)正常雨水的pH约为5.6,其原因是
(3)氯化钠是生活中常见的盐。为除去氯化钠中的泥沙和(
②加入
③加入稀盐酸的作用是
(4)下图为实验室模拟炼铁的实验装置。
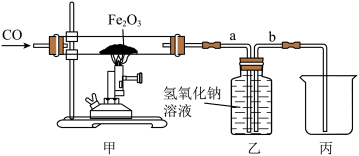
②已知集气瓶中盛放过量的氢氧化钠溶液,请设计实验证明实验后溶液中所含溶质的成分
(5)海水制“碱” v(Na2CO3)中含有少量的氯化钠。向盛有12g该“碱”样品的烧杯中加入足量的水充分溶解后,再加入过量的盐酸,充分反应后释放出二氧化碳4.4g。请计算该“碱”样品中碳酸钠质量分数是多少?(计算结果保留为0.1%)
2024·河南濮阳·一模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网