综合应用题 较难0.4 引用3 组卷85
考古发掘与研究表明:湖北省铜绿山古铜矿遗址是迄今已发掘的古铜矿中开采规模最大、采冶时间最长、冶炼水平最高、采冶链最完整、文化内涵最丰富的--处文化遗产。
Ⅰ.铜矿的开采与冶炼
(1)铜绿山主要矿石有孔雀石[主要成分:Cu2(OH)2CO3]和赤铜矿(主要成分:Cu2O),还存在少量自然铜(主要成分:Cu)。自然铜能在地壳中少量存在的原因是______ 。
(2)研究发现,铜绿山古铜矿采用了多种冶铜技术。例如,先破碎铜矿石至一定粒度才入炉冶炼,目的是______ 。
Ⅱ.青铜的铸造与锈蚀
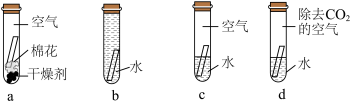
(3)纯铜制作的器皿使用时可能锈蚀成铜绿[主要成分:Cu2(OH)2CO3],由其化学式推测,下图试管中的铜片最易生锈的是______ (填字母)。______ 。但是,在含氯离子的地下土壤中,青铜表面会产生氯化亚铜(CuCl),氯化亚铜再进一步与地下水、地下氧(O2)作用生成碱式氯化铜[Cu2(OH)3Cl]和氯化氢,周而复始地腐蚀青铜器形成粉状锈,写出该反应的化学方程式______ 。
Ⅲ.青铜器的修复与维护
(5)青铜器表面的粉状锈可用锌粉转化法去除。用乙醇和锌粉调成胶状物涂抹在文物表层,将表面的锈迹修复成铜,此过程利用的化学原理是______ 。修复后的青铜器表面需用蒸馏水不断地冲洗,去除氯离子,检验青铜器表面的氯离子完全除去的方法是______ 。
(6)存放修复完成的青铜器时,操作合理的是______ (填字母)。
a.青铜器表面涂缓蚀剂
b.用自来水清洗青铜器表面的灰尘
c.搬运青铜器时戴棉质手套
d.保存在恒温、干燥、充氮气的储藏柜中
Ⅰ.铜矿的开采与冶炼
(1)铜绿山主要矿石有孔雀石[主要成分:Cu2(OH)2CO3]和赤铜矿(主要成分:Cu2O),还存在少量自然铜(主要成分:Cu)。自然铜能在地壳中少量存在的原因是
(2)研究发现,铜绿山古铜矿采用了多种冶铜技术。例如,先破碎铜矿石至一定粒度才入炉冶炼,目的是
Ⅱ.青铜的铸造与锈蚀
(3)纯铜制作的器皿使用时可能锈蚀成铜绿[主要成分:Cu2(OH)2CO3],由其化学式推测,下图试管中的铜片最易生锈的是
Ⅲ.青铜器的修复与维护
(5)青铜器表面的粉状锈可用锌粉转化法去除。用乙醇和锌粉调成胶状物涂抹在文物表层,将表面的锈迹修复成铜,此过程利用的化学原理是
(6)存放修复完成的青铜器时,操作合理的是
a.青铜器表面涂缓蚀剂
b.用自来水清洗青铜器表面的灰尘
c.搬运青铜器时戴棉质手套
d.保存在恒温、干燥、充氮气的储藏柜中
2024·江苏无锡·一模
类题推荐
铁及其化合物在生产生活有广泛的应用。
一、铁的相关知识
(1)磁铁矿是早期司南的材料,磁铁矿中所含铁的氧化物主要是___________ 。
(2)某钢中含有少量Mn。MnO2和Al粉混合在高温下反应可得到Mn,该反应的化学方程式为___________ 。
(3)用铁锅加热食物,说明铁具良好的有___________ 性。
(4)铁锈主要成分是Fe2O3·nH2O,铁生锈主要与空气中的___________ 有关。
二、废铁屑的利用
草酸铁钾晶体[K3Fe(C2O4)3·xH2O]是一种光敏材料。用废铁屑(主要成分为Fe,含少量Fe2O3)

制备该晶体主要流程如下:
(5)“酸溶”时,产生的气体X为___________ 。
(6)“转化1”中加入铁粉是将+3价的铁转化为+2价的铁,该反应的化学方程式为___________ 。
(7)“转化2”反应生成FeC2O4·nH2O的化学方程式是___________ 。
(8)“转化3”需控制一定的温度,但温度不能太高的原因是___________ 。
(9)“一系列操作”包含蒸发浓缩、___________ 、过滤、洗涤、干燥。其中过滤所用的玻璃仪器有漏斗、烧杯、___________ 。
三、草酸铁钾晶体的实验
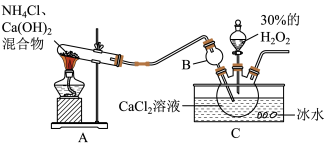
称取9.82g草酸铁钾晶体,用下图装置进行热分解实验。

【资料】
①Mr[K3Fe(C2O4)3]=437
②草酸铁钾晶体在110℃时失去全部结晶水,230℃时完全分解生成K2CO3、Fe、FeO、CO、CO2。
(10)连接好装置后,要先___________ 。
(11)控制温度对A中固体加热,加热前后及过程中均需通入N2.当加热到110℃后,通入N2的目的是防止倒吸和___________ 。
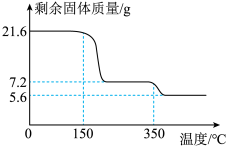
(12)数据处理:测得B、C装置在不同温度下的质量,如下表所示。230℃反应结束后,A中剩余固体5.42g。
计算:
①x=___________ 。
②尾气处理的方法可以是___________ 。
③上述K3Fe(C2O4)3热分解的化学方程式___________ 。
一、铁的相关知识
(1)磁铁矿是早期司南的材料,磁铁矿中所含铁的氧化物主要是
(2)某钢中含有少量Mn。MnO2和Al粉混合在高温下反应可得到Mn,该反应的化学方程式为
(3)用铁锅加热食物,说明铁具良好的有
(4)铁锈主要成分是Fe2O3·nH2O,铁生锈主要与空气中的
二、废铁屑的利用
草酸铁钾晶体[K3Fe(C2O4)3·xH2O]是一种光敏材料。用废铁屑(主要成分为Fe,含少量Fe2O3)

制备该晶体主要流程如下:
(5)“酸溶”时,产生的气体X为
(6)“转化1”中加入铁粉是将+3价的铁转化为+2价的铁,该反应的化学方程式为
(7)“转化2”反应生成FeC2O4·nH2O的化学方程式是
(8)“转化3”需控制一定的温度,但温度不能太高的原因是
(9)“一系列操作”包含蒸发浓缩、
三、草酸铁钾晶体的实验
称取9.82g草酸铁钾晶体,用下图装置进行热分解实验。

【资料】
①Mr[K3Fe(C2O4)3]=437
②草酸铁钾晶体在110℃时失去全部结晶水,230℃时完全分解生成K2CO3、Fe、FeO、CO、CO2。
(10)连接好装置后,要先
(11)控制温度对A中固体加热,加热前后及过程中均需通入N2.当加热到110℃后,通入N2的目的是防止倒吸和
(12)数据处理:测得B、C装置在不同温度下的质量,如下表所示。230℃反应结束后,A中剩余固体5.42g。
| 温度/℃ | 室温 | 110 | 230 |
| B装置/g | 200.00 | 201.08 | 201.08 |
| C装置/g | 200.00 | 200.00 | 202.20 |
①x=
②尾气处理的方法可以是
③上述K3Fe(C2O4)3热分解的化学方程式
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网