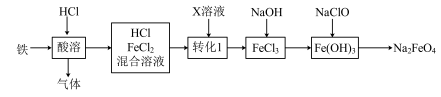
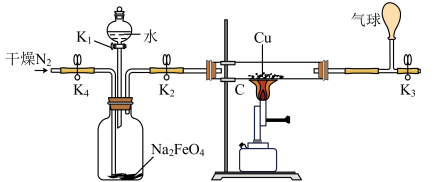
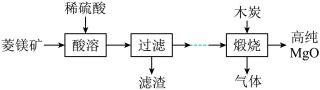
实验题 较难0.4 引用3 组卷129
测定某种大理石中碳酸钙(杂质不与酸反应)的质量百分含量。取样10g大理石,粉碎后进行如下实验流程:______ 。
(2)“混合物A”属于______ (选填“溶液”、“乳浊液”或“悬浊液”)。
(3)实验前,取样的意义是______ 。
(4)实验过程中,为保证盐酸过量,有以下三种方案可供选择:
方案一:加入盐酸,观察有无气泡产生,没有气泡产生,就停止滴加盐酸
方案二:不间断测定反应过程中溶液的pH,若小于7,就停止滴加盐酸
方案三:直接加入约含0.22 mol HCl的盐酸
请你对这三种方案的可行性进行评价,填入下表:
根据评价,上述最佳方案是______ 。
(5)实验步骤Ⅲ中,形成碳酸钙的化学方程式是______ 。
(6)为达成实验目的,还需要获得的实验数据是______ 。
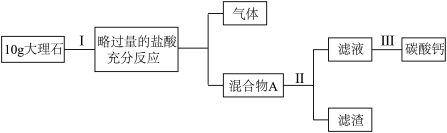
(2)“混合物A”属于
(3)实验前,取样的意义是
(4)实验过程中,为保证盐酸过量,有以下三种方案可供选择:
方案一:加入盐酸,观察有无气泡产生,没有气泡产生,就停止滴加盐酸
方案二:不间断测定反应过程中溶液的pH,若小于7,就停止滴加盐酸
方案三:直接加入约含0.22 mol HCl的盐酸
请你对这三种方案的可行性进行评价,填入下表:
| 方案 | 评价 |
| 一 | |
| 二 | |
| 三 |
(5)实验步骤Ⅲ中,形成碳酸钙的化学方程式是
(6)为达成实验目的,还需要获得的实验数据是
2024·上海普陀·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网