科学探究题 适中0.65 引用3 组卷140
在一次研学活动中,校科技小组的同学发现某沿海城市一小区围墙铁艺栏杆锈蚀严重,于是围绕“铁艺栏杆锈蚀”这一主题展开了项目式学习。
任务一:交流铁艺栏杆锈蚀的条件及防护
【查阅资料】铁艺栏杆为钢铁制品。钢铁被广泛应用于交通运输、机械设备、建筑等领域,据统计,每年全球的钢铁产量达数十亿吨,因锈蚀而损失的钢铁量占全年生产量的1/4。
【小组交流】
(1)钢铁锈蚀的条件是______ ,防止铁艺栏杆锈蚀的措施有______ (写一点)。
任务二:探究铁艺栏杆锈蚀严重的原因
【信息检索】沿海地区空气湿度大,盐雾含量高,盐雾的主要成分为氯化钠。
【进行实验】小组同学用图1所示的装置进行实验,实验数据如图2所示。
(2)通过对比图2中曲线,可以得出的结论是______ 。
任务三:探究该城市空气中是否含有氯化钠
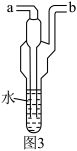
【实验准备】用图3所示的装置采样。一端连接抽气泵抽气,空气从另一端进入水中,一段时间后,取出装置中溶液备用。
①灼烧含钠的物质会产生黄色火焰。
② 为既不溶于水,也不溶于硝酸的白色沉淀。
为既不溶于水,也不溶于硝酸的白色沉淀。
【进行实验】
(3)为证明该城市空气中含有氯化钠,小组同学设计如下方案,并进行实验。
【反思评价】
(4)该沿海城市空气中含有氯化钠,采集空气样品时,抽气泵应与图3装置的______ 端连接。
(5)步骤Ⅱ中发生复分解反应的化学方程式为______ 。
任务四:展望金属资源的保护
【走访调查】同学们通过走访,知道了金属材料在生产、生活中的重要作用,了解到金属矿物资源是有限的,不能再生。
【成果分享】
(6)通过探究学习,同学们进一步认识了钢铁锈蚀的条件、影响锈蚀速率的因素及保护金属资源的重要性,提出了防止金属腐蚀、______ 等保护金属资源有效途径的建议。
任务一:交流铁艺栏杆锈蚀的条件及防护
【查阅资料】铁艺栏杆为钢铁制品。钢铁被广泛应用于交通运输、机械设备、建筑等领域,据统计,每年全球的钢铁产量达数十亿吨,因锈蚀而损失的钢铁量占全年生产量的1/4。
【小组交流】
(1)钢铁锈蚀的条件是
任务二:探究铁艺栏杆锈蚀严重的原因
【信息检索】沿海地区空气湿度大,盐雾含量高,盐雾的主要成分为氯化钠。
【进行实验】小组同学用图1所示的装置进行实验,实验数据如图2所示。

(2)通过对比图2中曲线,可以得出的结论是
任务三:探究该城市空气中是否含有氯化钠
【实验准备】用图3所示的装置采样。一端连接抽气泵抽气,空气从另一端进入水中,一段时间后,取出装置中溶液备用。
①灼烧含钠的物质会产生黄色火焰。
②
【进行实验】
(3)为证明该城市空气中含有氯化钠,小组同学设计如下方案,并进行实验。
| 实验操作 | 实验现象 | 实验结论 |
| Ⅰ.用洁净的铁丝蘸取该溶液,放到火焰上灼烧 | 火焰为黄色 | 含有 |
| Ⅱ.取少量该溶液于试管中,滴加几滴稀硝酸和 | 产生白色沉淀 | 含有 |
【反思评价】
(4)该沿海城市空气中含有氯化钠,采集空气样品时,抽气泵应与图3装置的
(5)步骤Ⅱ中发生复分解反应的化学方程式为
任务四:展望金属资源的保护
【走访调查】同学们通过走访,知道了金属材料在生产、生活中的重要作用,了解到金属矿物资源是有限的,不能再生。
【成果分享】
(6)通过探究学习,同学们进一步认识了钢铁锈蚀的条件、影响锈蚀速率的因素及保护金属资源的重要性,提出了防止金属腐蚀、
2024·山西太原·模拟预测
类题推荐
现在食品包装袋中常放有一包“双吸防腐剂”,青少年的好奇天性促使同学们对“双吸防腐剂”成分产生了极大兴趣,他们将一包“防腐剂”倒在滤纸上,看到“防腐剂”中有一些黑色粉末和红褐色粉末,为此展开以下探究活动:
【提出问题】“防腐剂”中黑色的粉末和红褐色的粉末分别是什么?
【查阅资料】食品腐败主要是因为食品易与空气中的氧气和水蒸气反应、潮解而变质, 使用该“防腐剂”可延长食品的保质期;氧化铁可与稀盐酸反应生成氯化铁和水,溶液因含Fe3+呈黄色。
【提出猜想】婷婷:“防腐剂”中黑色的粉末是氧化铜,红色的粉末是铜。
燕燕:“防腐剂”中黑色的粉末是碳粉,红色的粉末是铜。
婉君:“防腐剂”中黑色的粉末是铁粉和碳粉,红色的粉末是氧化铁。
【讨论分析】同学们通过查资料、请教老师及讨论,都认为婉君同学猜想是正确的。
【实验探究】取样准备实验,请你参与她们的探究,并一起将实验报告补充完整。
【拓展探究】为了进一步探究“防腐剂”的性质,探究的同学称取一些久置的“防腐剂”粉末装入硬质玻璃管中,进行了如图所示的规范操作实验。
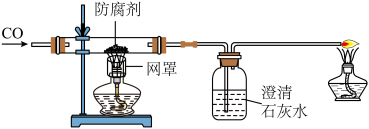
(1)实验开始前老师要求同学们先通一会儿CO,原因是__________________ 。
(2)实验结束通过称量反应前后硬质玻璃管中固体物质的质量,发现反应后红色固体物质变成了黑色而且质量减小,质量减小的原因__________________________ 。
【提出问题】“防腐剂”中黑色的粉末和红褐色的粉末分别是什么?
【查阅资料】食品腐败主要是因为食品易与空气中的氧气和水蒸气反应、潮解而变质, 使用该“防腐剂”可延长食品的保质期;氧化铁可与稀盐酸反应生成氯化铁和水,溶液因含Fe3+呈黄色。
【提出猜想】婷婷:“防腐剂”中黑色的粉末是氧化铜,红色的粉末是铜。
燕燕:“防腐剂”中黑色的粉末是碳粉,红色的粉末是铜。
婉君:“防腐剂”中黑色的粉末是铁粉和碳粉,红色的粉末是氧化铁。
【讨论分析】同学们通过查资料、请教老师及讨论,都认为婉君同学猜想是正确的。
【实验探究】取样准备实验,请你参与她们的探究,并一起将实验报告补充完整。
| 实验步骤及操作 | 实验现象 | 实验结论 |
| ①.用磁铁接近滤纸上的“双吸防腐剂”,并充分吸引。 | 磁铁吸走了部分黑色物质 | 黑色粉末一定含有 |
| ②.取①中剩余的粉末于试管中,加入足量的 | 红色粉末全部消失,试管底部有少量黑色固体,溶液由无色变黄色。 | 婉君猜想成立,写出化学方程式: |

(1)实验开始前老师要求同学们先通一会儿CO,原因是
(2)实验结束通过称量反应前后硬质玻璃管中固体物质的质量,发现反应后红色固体物质变成了黑色而且质量减小,质量减小的原因
在学习金属时,同学们了解到镁能与铝、锌等组成很有工业价值的实用合金,在航天航空、交通运输、国防军工、光学仪器、家用电器等领域有广泛用途,于是项目小组的同学对镁开展了探究活动。
任务一:认识镁
(1)用砂纸打磨镁条并观察,可知金属镁具有的物理性质是______ 。镁位于元素周期表中的第 12 位。如图是镁的粒子结构示意图。请你根据图中信息判断,该粒子表示的是______ (填化学符号)。
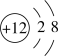
任务二:分析镁在空气中的变化
(2)同学们将打磨过的光亮镁条放在空气中,一段时间后观察到颜色逐渐变暗。查阅资料后了解到,常温下,镁在空气中会发生氧化,化学方程式为______ 。
任务三:探究镁、铜、铁的金属活动性顺序
为了探究镁、铜、铁的金属活动性顺序,同学们进行了如下实验。
(3)【进行实验】
【反思与评价】
(4)实验一中发生反应的化学方程式为______ 。
(5)小红认为通过实验一和实验二,不能比较 Mg 和 Fe 的金属活动性顺序,原因是______ 。
(6)小明提出,实验结束后试管中的金属可以回收再利用,这样做的意义是______ 。
任务一:认识镁
(1)用砂纸打磨镁条并观察,可知金属镁具有的物理性质是
任务二:分析镁在空气中的变化
(2)同学们将打磨过的光亮镁条放在空气中,一段时间后观察到颜色逐渐变暗。查阅资料后了解到,常温下,镁在空气中会发生氧化,化学方程式为
任务三:探究镁、铜、铁的金属活动性顺序
为了探究镁、铜、铁的金属活动性顺序,同学们进行了如下实验。
(3)【进行实验】
| 实验 | 实验操作 | 实验现象 | 实验分析与结论 |
| 实验一 | 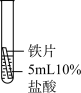 | 有少量气泡产生,铁片逐渐溶解,溶液由无色变为浅绿色 | 对比实验①②,可知金属活动性顺序:Mg>Fe;根据实验③可知金属活动性顺序: |
| 实验二 | 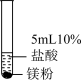 | ||
| 实验三 | 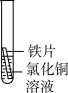 | 铁片上有红色固体析出,溶液由蓝色变成浅绿色 |
【反思与评价】
(4)实验一中发生反应的化学方程式为
(5)小红认为通过实验一和实验二,不能比较 Mg 和 Fe 的金属活动性顺序,原因是
(6)小明提出,实验结束后试管中的金属可以回收再利用,这样做的意义是
兴趣小组同学发现省博物馆内许多铜鼓表面有一层绿色物质。同学们设计实验对这种绿色物质进行了下列探究活动。
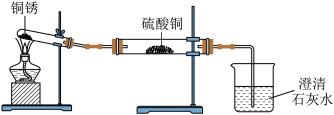
【查阅资料】
①铜在空气中易生成铜锈,它为绿色,其主要成分是Cu2(OH)2CO3;
②白色的无水硫酸铜粉末遇水能变为蓝色。
(1)验证铜锈的组成,同学们设计了如图所示装置并进行实验。
(2)探究铜生锈的条件。
同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显。
【实验结论】铜生锈的条件是 ________ 。
【拓展探究】同学们在博物馆买到一只金黄色的小铜鼓纪念品,大家对它的主要成分又展开探究。
【提出问题】这块黄色的金属是黄金还是铜锌合金?
【猜想】①小新认为是黄金;②小宝认为是铜锌合金。
【查阅资料】合金中的金属保持各自的化学性质,金在高温下不与氧气反应,锌在高温下与氧气反应生成白色固体。
【设计实验】
①小新设计的实验:截取一小片黄色的金属放在陶土网上用酒精灯加热;
②小宝设计的实验:截取一小片黄色的金属放入硝酸银溶液中。
【现象与结论】
①小新在实验中观察到黄色的金属变黑,则他的猜想______ ,请写出生成该黑色物质的化学方程式:______ 。
②若小宝的猜想成立,在实验中能观察到的现象是______ 。
【能力发展】保护金属资源的有效途径______ (写一条)。

【查阅资料】
①铜在空气中易生成铜锈,它为绿色,其主要成分是Cu2(OH)2CO3;
②白色的无水硫酸铜粉末遇水能变为蓝色。
(1)验证铜锈的组成,同学们设计了如图所示装置并进行实验。
| 实验操作 | 实验现象 | 实验结论 |
| ①按如图组装仪器,装入药品。 ②加热铜锈,直至不再有气体产 生,停止加热 | 绿色固体变为黑色;无水 硫酸铜粉末变为蓝色;烧 杯中液体变浑浊 | 铜锈中一定含有 |
| ③冷却后,向试管中固体加入适量 稀硫酸,稍加热 | 铜锈中含有铜元素 |
同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显。
| 序号 | 实验1 | 实验2 | 实验3 | 实验4 |
| 实验内容 | 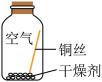 | 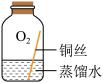 |  | 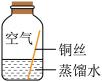 |
| 实验现象 | 在干燥环境中,铜不生锈 | 铜仅与氧气和水接触,不生锈 | 铜仅与二氧化碳和水接触,不生锈 | 铜生锈 |
【拓展探究】同学们在博物馆买到一只金黄色的小铜鼓纪念品,大家对它的主要成分又展开探究。
【提出问题】这块黄色的金属是黄金还是铜锌合金?
【猜想】①小新认为是黄金;②小宝认为是铜锌合金。
【查阅资料】合金中的金属保持各自的化学性质,金在高温下不与氧气反应,锌在高温下与氧气反应生成白色固体。
【设计实验】
①小新设计的实验:截取一小片黄色的金属放在陶土网上用酒精灯加热;
②小宝设计的实验:截取一小片黄色的金属放入硝酸银溶液中。
【现象与结论】
①小新在实验中观察到黄色的金属变黑,则他的猜想
②若小宝的猜想成立,在实验中能观察到的现象是
【能力发展】保护金属资源的有效途径
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


