科学探究题 适中0.65 引用2 组卷55
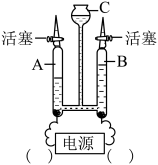
同学们在学习碱的化学性质时,进行了如图所示的实验。

【学习交流】
(1)做甲图所示实验时,当溶液恰好由红色变为无色,停止滴加稀盐酸,写出发生反应的化学方程式:_____ 。
【处理废液】
(2)实验结束后,同学们将甲、乙中的上层清液倒入同一个洁净的废液缸,发现废液明显变浑浊且呈红色。废液变浑浊是因为反应生成了_____ (填化学式)。
【提出问题】使废液变为红色的物质是什么?
【做出猜想】猜想一:只有
猜想二:只有
猜想三: 和
和
(3)小明认为上述猜想二不合理,理由是_____ 。
【查阅资料】溶液呈中性。
【讨论交流】
(4)在讨论方案时,某些同学认为可以取少量废液缸中上层清液于试管中,加入过量 溶液,根据实验现象来验证其余两种猜想,其中小西、小安两位同学的观点如表。
溶液,根据实验现象来验证其余两种猜想,其中小西、小安两位同学的观点如表。
【进行实验】同学们进行实验,通过观察实验现象,得出了猜想三成立。
【反思拓展】
(5)大家认为还可以选择其他方案来验证猜想。你认为下列方案可行的是_____ (填序号)。
①向上层清液中滴加 溶液
溶液
②向上层清液中逐滴加入少量稀盐酸
③向上层清液中滴加 溶液
溶液

【学习交流】
(1)做甲图所示实验时,当溶液恰好由红色变为无色,停止滴加稀盐酸,写出发生反应的化学方程式:
【处理废液】
(2)实验结束后,同学们将甲、乙中的上层清液倒入同一个洁净的废液缸,发现废液明显变浑浊且呈红色。废液变浑浊是因为反应生成了
【提出问题】使废液变为红色的物质是什么?
【做出猜想】猜想一:只有
猜想二:只有
猜想三:
(3)小明认为上述猜想二不合理,理由是
【查阅资料】溶液呈中性。
【讨论交流】
(4)在讨论方案时,某些同学认为可以取少量废液缸中上层清液于试管中,加入过量
| 同学 | 预测实验现象 | 结论 |
| 小西 | 猜想一成立 | |
| 小安 | 猜想三成立 |
【进行实验】同学们进行实验,通过观察实验现象,得出了猜想三成立。
【反思拓展】
(5)大家认为还可以选择其他方案来验证猜想。你认为下列方案可行的是
①向上层清液中滴加
②向上层清液中逐滴加入少量稀盐酸
③向上层清液中滴加
2024·陕西延安·一模
类题推荐
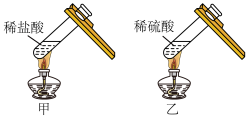
化学小组进行如图所示实验:将稀盐酸、稀硫酸分别加入装有少量氧化铜粉末的试管甲、乙中,微热,观察到黑色固体完全溶解,试管甲中的溶液显绿色,试管乙中的溶液显蓝色。激发了他们的兴趣,进行如下深究活动。___________ 。
探究一:为什么CuCl2溶液显绿色而CuSO4溶液显蓝色?
【猜想与假设】①硫酸铜溶液显蓝色与硫酸根离子有关;②氯化铜溶液显绿色与氯离子有关。
【实验1】
(2)取少量氧化铜粉末于试管中,加入一定量的稀硝酸,加热,观察到黑色固体完全溶解,溶液仍显蓝色,说明硫酸铜溶液显蓝色与___________ 无关,而是与铜离子有关。
【实验2】
(3)取试管乙中的溶液滴加一定量的___________ ,观察到溶液由蓝色变绿色,则猜想②成立。
(4)请你再设计一个实验证明猜想②成立:取试管甲中的溶液,___________ (请简述实验操作与现象)。
探究二:氯化铜溶液显绿色是否与溶液的浓度有关。
【实丝3】步骤I:用托盘天平称取无水氯化铜固体5.0g置于小烧杯中;
步骤Ⅱ:往小烧杯中加入一定量的蒸馏水,搅拌,观察溶液的颜色并记录。
室温下的实验现象及数据记录如下表(ρ水=1g/mL):
(5)上述实验可以得到的结论是___________ 。
探究一:为什么CuCl2溶液显绿色而CuSO4溶液显蓝色?
【猜想与假设】①硫酸铜溶液显蓝色与硫酸根离子有关;②氯化铜溶液显绿色与氯离子有关。
【实验1】
(2)取少量氧化铜粉末于试管中,加入一定量的稀硝酸,加热,观察到黑色固体完全溶解,溶液仍显蓝色,说明硫酸铜溶液显蓝色与
【实验2】
(3)取试管乙中的溶液滴加一定量的
(4)请你再设计一个实验证明猜想②成立:取试管甲中的溶液,
探究二:氯化铜溶液显绿色是否与溶液的浓度有关。
【实丝3】步骤I:用托盘天平称取无水氯化铜固体5.0g置于小烧杯中;
步骤Ⅱ:往小烧杯中加入一定量的蒸馏水,搅拌,观察溶液的颜色并记录。
室温下的实验现象及数据记录如下表(ρ水=1g/mL):
| 加入水的体积/mL | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 |
| 溶液颜色 | 深绿 | 墨绿 | 墨绿 | 蓝绿 | 绿色 | 深蓝 | 蓝色 | 蓝色 | 浅蓝 | 淡蓝 |
(5)上述实验可以得到的结论是
某化学兴趣小组的同学为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动:
【查阅资料】金属活动性强的金属可以把金属活动性弱的金属从它的化合物溶液中置换出来。
【进行猜想】对三种金属的活动性顺序作出如下猜想:
猜想一:R>Fe>Cu;
猜想二:Fe>R>Cu;
猜想三:Fe>Cu>R
【收集证据】
(1)为了验证哪―种猜想成立,甲、乙,丙三位同学分别展开实验探究。
(2)铁丝与硫酸铜反应的化学方程式为___________ 。
【交流反思】
(3)三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。你认为甲同学的实验_______ (填“合理”或“不合理”),理由是________ 。
【归纳总结】
(4)他们总结得出比较金属活动性强弱的常见方法有:
①金属与某些金属的化合物溶液反应。
②金属与酸溶液反应。
③金属与___________ 反应。
【查阅资料】金属活动性强的金属可以把金属活动性弱的金属从它的化合物溶液中置换出来。
【进行猜想】对三种金属的活动性顺序作出如下猜想:
猜想一:R>Fe>Cu;
猜想二:Fe>R>Cu;
猜想三:Fe>Cu>R
【收集证据】
(1)为了验证哪―种猜想成立,甲、乙,丙三位同学分别展开实验探究。
| 操作 | 现象 | 实验结论 | |
| 甲 | 1.将打磨好的R丝插入盛有硫酸铜溶液的试管中 2.将打磨好的铁丝插入盛有硫酸铜溶液的试管中 | 1.R丝表面有红色固体析出 2. | 现象1得出金属活动性 |
| 乙 | 将粗细相同打磨好的R丝、铁丝、铜丝,分别插入体积和溶质质量分数都相同的稀盐酸中 | R丝、铁丝表面产生气泡﹐铜丝表面无明显变化 | 猜想 |
| 丙 | 将粗细相同打磨好的R丝、铁丝,分别在空气中点燃 | R丝在空气中剧烈燃烧﹐铁丝在空气中不燃烧 |
【交流反思】
(3)三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。你认为甲同学的实验
【归纳总结】
(4)他们总结得出比较金属活动性强弱的常见方法有:
①金属与某些金属的化合物溶液反应。
②金属与酸溶液反应。
③金属与
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网