实验题 适中0.65 引用1 组卷91
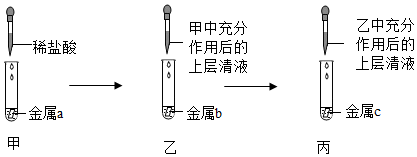
利用如图实验探究金属的化学性质。

(1)实验一:写出铁丝在氧气中燃烧的化学方程式______ ,实验中水的作用是______ 。
(2)实验二:两个反应均生成了______ (填物质名称)。比较铁和铝的金属活动性强弱,从试剂角度需考虑:①加入同样大小的铁片和铝片;②______ 。
(3)如下图,将金属X插入烧杯内的AgNO3溶液中,观察到溶液颜色变蓝后取出X,向烧杯内再加入一定量锌粉,振荡后,溶液蓝色逐渐消失。
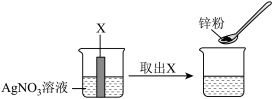
a.金属X是______ ;
b.加入锌粉,溶液蓝色消失的原因是______ (用化学方程式表示)。
c.实验结束后,烧杯内的溶液中一定______ (填“存在”或“不存在”)AgNO3。

(1)实验一:写出铁丝在氧气中燃烧的化学方程式
(2)实验二:两个反应均生成了
(3)如下图,将金属X插入烧杯内的AgNO3溶液中,观察到溶液颜色变蓝后取出X,向烧杯内再加入一定量锌粉,振荡后,溶液蓝色逐渐消失。

a.金属X是
b.加入锌粉,溶液蓝色消失的原因是
c.实验结束后,烧杯内的溶液中一定
23-24九年级上·江苏泰州·阶段练习
类题推荐
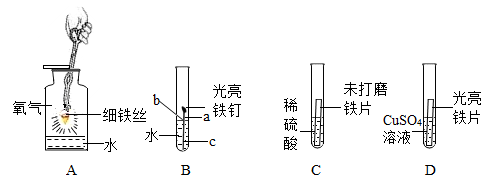
某化学兴趣小组为探究铝和铜的金属活动性强弱,开展了以下探究活动。
【探究实验】
(1)比较实验乙和实验___________ (选填“甲”或“丙”)可知:打磨能破坏氧化铝薄膜。
(2)实验乙中发生反应的化学方程式为___________ ,据此可知金属活动性Al比Cu___________ ;(选填“强”或“弱”)
(3)查阅资料得知:CuSO4溶液中有Cu2+、 、H2O三种粒子,CuCl2溶液中有Cu2+、Cl-、H2O三种粒子。
、H2O三种粒子,CuCl2溶液中有Cu2+、Cl-、H2O三种粒子。
下列是小林同学对实验丙的现象进行的分析,你认为下列猜想合理的是__________ (填字母)。
A H2O破坏了氧化铝薄膜
B Cl-破坏了氧化铝薄膜
C Cu2+破坏了氧化铝薄膜
D 破坏了氧化铝薄膜
破坏了氧化铝薄膜
【探究实验二】将铝丝和铜丝分别浸入相同质量、相同质量分数的稀硫酸中,铜丝不反应;一段时间后铝丝的表面产生大量气泡,氢气的产生速度与时间的关系如图所示。
(4)铝丝反应过程中试管外壁发烫,说明该反应会___________ (选填“吸收”或“放出”) 热量。
(5)图中0~a段未产生气体的原因是___________ ,b点所对应溶液中的溶质有___________ (填化学式),c~d段产生氢气的速率下降的主要原因是___________ 。

【探究实验】
| 编号 | 甲 | 乙 | 丙 |
| 实验操作 | 将表面未打磨的铝丝浸入CuSO4溶液中 | 将表面打磨后的铝丝 浸入CuSO4液中 | 将表面未打磨的铝丝浸入CuCl2液中 |
| 实验现象 | 无明显现象 | 铝丝表面析出红色固体 | 铝丝表面析出红色固体 |
(2)实验乙中发生反应的化学方程式为
(3)查阅资料得知:CuSO4溶液中有Cu2+、
下列是小林同学对实验丙的现象进行的分析,你认为下列猜想合理的是
A H2O破坏了氧化铝薄膜
B Cl-破坏了氧化铝薄膜
C Cu2+破坏了氧化铝薄膜
D
【探究实验二】将铝丝和铜丝分别浸入相同质量、相同质量分数的稀硫酸中,铜丝不反应;一段时间后铝丝的表面产生大量气泡,氢气的产生速度与时间的关系如图所示。
(4)铝丝反应过程中试管外壁发烫,说明该反应会
(5)图中0~a段未产生气体的原因是

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网