综合应用题 较难0.4 引用1 组卷147
我国力争在2060年前实现“碳中和”,彰显了大国的责任和担当。“碳”减排、“碳”捕集、“碳”封存、“碳”利用是实现碳中和的4种主要途径。
(1)“碳”减排:下列对节能减排的建议不可行的是 (填字母)。
(2)“碳”捕集:自然界“碳捕集”主要利用绿色植物的_______ 作用吸收CO2。
(3)“碳”封存:“碳”封存技术是将CO2送入3000米深海海底变成液态CO2湖,此过程中CO2分子的性质_______ (选填“有”或“没有”)发生改变。
(4)“碳”利用:尿素[CO(NH2)2]是一种常用化肥,图1是利用空气等制尿素的主要流程。
①分离空气的常用方法有以下两种:
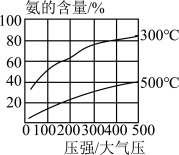
a.将液态空气汽化,首先分离出气体X,则沸点:N2____ O2(选填“>”或“<”)。
b.分子筛是一种内部分布有均匀微小孔径的固体,空气中的氧分子可通过分子筛的孔穴而与其他分子分离,则分子大小:N2____ O2(选填“>”或“<”)。
②由燃烧在该流程中的作用表明:化学变化的同时也会伴随____ 变化。
③合成过程中,制备尿素的符号表达式为____ 。
④图2为某尿素样品的部分标签(杂质中不含氮元素),根据标签计算:
a.该袋化肥中氮元素的质量为____ kg。
b.该化肥中尿素的质量分数为____ 。
(1)“碳”减排:下列对节能减排的建议不可行的是 (填字母)。
| A.停止使用煤和石油 | B.推广使用光伏发电 |
| C.多骑共享单车出行 | D.践行光盘杜绝浪费 |
(2)“碳”捕集:自然界“碳捕集”主要利用绿色植物的
(3)“碳”封存:“碳”封存技术是将CO2送入3000米深海海底变成液态CO2湖,此过程中CO2分子的性质
(4)“碳”利用:尿素[CO(NH2)2]是一种常用化肥,图1是利用空气等制尿素的主要流程。
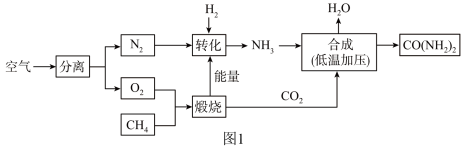

①分离空气的常用方法有以下两种:
a.将液态空气汽化,首先分离出气体X,则沸点:N2
b.分子筛是一种内部分布有均匀微小孔径的固体,空气中的氧分子可通过分子筛的孔穴而与其他分子分离,则分子大小:N2
②由燃烧在该流程中的作用表明:化学变化的同时也会伴随
③合成过程中,制备尿素的符号表达式为
④图2为某尿素样品的部分标签(杂质中不含氮元素),根据标签计算:
a.该袋化肥中氮元素的质量为
b.该化肥中尿素的质量分数为
23-24九年级上·江苏扬州·期中
类题推荐
轻质碳酸钙常用作食品、药品添加剂。以白云石(MgCO3·CaCO3)为原料制备轻质碳酸钙的主要工艺流程如下。 X+CaO+2CO2↑,则X的化学式为
X+CaO+2CO2↑,则X的化学式为_____ ,该反应属于_____ (填字母)。
a.置换反应 b.分解反应 c.化合反应 d.复分解反应
(2)“相转移”的主要目的将煅烧灰中的Ca2+尽可能多地转移到柠檬酸钙中,并使柠檬酸钙中残留的杂质(Mg2+)尽可能的少。为了探究液固比(水的体积和煅绕粉的质量比)对Ca2+转化率、Mg2+残留率的影响,设计了如下实验方案。
①“相转移”过程中需要进行过滤操作。下列关于过滤操作的叙述中,不正确的是_______ (填字母)。
a.滤纸的边缘要低于漏斗口 b.液面不要低于滤纸的边缘
c.玻璃棒要靠在三层滤纸的一边 d.漏斗下端的管口要紧靠烧杯的内壁
②上表中第四列对应的物理量是________ 。
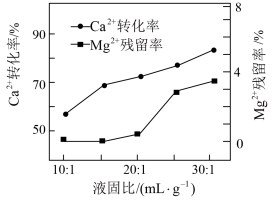
③为了提高Ca2+转化率且控制Mg2+残留率小于1%。据图1判断生产时应选择的最佳液固比为____ (填字母)。
(3)“碳化”。将柠檬酸钙[Ca3(C6H5O7)2]加入三颈瓶(图-2所示)中,加水配制成悬浊液,然后加入氨水,再通入CO2气体至pH为7.6,过滤、洗涤、烘干得轻质碳酸钙。
【已知】Ⅰ.氨水(NH3·H2O)易挥发,通常状况下,1体积水大约溶解1体积CO2气体,Ca(HCO3)2、CaCO3的溶解度分别为16.6g、5.3×10-4g。
反应一:2 NH3·H2O+CO2=(NH4)2CO3+H2O;
反应二:(NH4)2CO3与柠檬酸钙发生复分解反应生成CaCO3。
①实验发现当水浴温度过高时,柠檬酸钙的转化率下降,可能的原因是_______ 。
②写出反应二的化学方程式:________ 。
③当体系的pH小于7.6后,随着CO2的不断通入,轻质碳酸钙的产量逐渐降低,可能原因是_______ 。
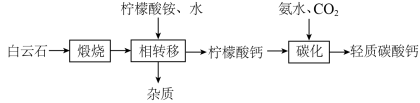
a.置换反应 b.分解反应 c.化合反应 d.复分解反应
(2)“相转移”的主要目的将煅烧灰中的Ca2+尽可能多地转移到柠檬酸钙中,并使柠檬酸钙中残留的杂质(Mg2+)尽可能的少。为了探究液固比(水的体积和煅绕粉的质量比)对Ca2+转化率、Mg2+残留率的影响,设计了如下实验方案。
| 编号 | 水的体积 | 煅烧粉的质量 | _____ | Ca2+转化率 | Mg2+残留率 |
| 实验一 | 50mL | 5g | 10g | ||
| 实验二 | 100mL | 5g | 10g | ||
| 实验三 | 150mL | 5g | 10g |
a.滤纸的边缘要低于漏斗口 b.液面不要低于滤纸的边缘
c.玻璃棒要靠在三层滤纸的一边 d.漏斗下端的管口要紧靠烧杯的内壁
②上表中第四列对应的物理量是
③为了提高Ca2+转化率且控制Mg2+残留率小于1%。据图1判断生产时应选择的最佳液固比为
(3)“碳化”。将柠檬酸钙[Ca3(C6H5O7)2]加入三颈瓶(图-2所示)中,加水配制成悬浊液,然后加入氨水,再通入CO2气体至pH为7.6,过滤、洗涤、烘干得轻质碳酸钙。
【已知】Ⅰ.氨水(NH3·H2O)易挥发,通常状况下,1体积水大约溶解1体积CO2气体,Ca(HCO3)2、CaCO3的溶解度分别为16.6g、5.3×10-4g。

反应一:2 NH3·H2O+CO2=(NH4)2CO3+H2O;
反应二:(NH4)2CO3与柠檬酸钙发生复分解反应生成CaCO3。
①实验发现当水浴温度过高时,柠檬酸钙的转化率下降,可能的原因是
②写出反应二的化学方程式:
③当体系的pH小于7.6后,随着CO2的不断通入,轻质碳酸钙的产量逐渐降低,可能原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网