计算题 较难0.4 引用1 组卷113
小丽同学为了测定黄铜样品中铜的质量分数,进行了如下实验。请回答下列问题:
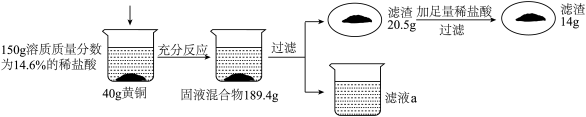
(1)上述实验过程中发生反应的化学方程式为________ 。
(2)列出求解第一次加入稀盐酸后黄铜中参加反应的锌的质量(x)的比例式________ 。
(3)此黄铜中铜的质量分数为________ 。
(4)若将反应后的滤液a加入31.1g水,所得溶液中氯化锌的质量分数为________ 。
(5)若要生产该黄铜320t,需要含杂质20%的辉铜矿的质量为________ 。

(1)上述实验过程中发生反应的化学方程式为
(2)列出求解第一次加入稀盐酸后黄铜中参加反应的锌的质量(x)的比例式
(3)此黄铜中铜的质量分数为
(4)若将反应后的滤液a加入31.1g水,所得溶液中氯化锌的质量分数为
(5)若要生产该黄铜320t,需要含杂质20%的辉铜矿的质量为
23-24九年级上·黑龙江哈尔滨·期中
类题推荐
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取10g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应,每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题:
(1)从以上数据可知,最后剩余的5.6g固体的成分是__________ ;表格中,m=_________ ;
(2)黄铜样品中锌的质量分数为_________ ;
(3)计算所用稀硫酸中硫酸的质量分数是多少?
| 加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
| 第1次 | 10 | m |
| 第2次 | 10 | 7.4 |
| 第3次 | 10 | 6.1 |
| 第4次 | 10 | 5.6 |
| 第5次 | 10 | 5.6 |
(1)从以上数据可知,最后剩余的5.6g固体的成分是
(2)黄铜样品中锌的质量分数为
(3)计算所用稀硫酸中硫酸的质量分数是多少?
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


