科学探究题 较难0.4 引用10 组卷1083
分类回收塑料制品是环境保护的重要研究课题。化学兴趣小组利用过氧化氢溶液取氧气,并用燃烧法探究塑料的组成。
I、设计氧气的发生装图______ (填“集气瓶”或“锥形瓶”)。
(2)图2中铂丝可催化过氧化氢分解产生氧气。实验过程中,若观察到安全管内液面上升,说明装置内压强过大,此时可以采取的安全措施是______ 。
Ⅱ、探究某塑料的组成
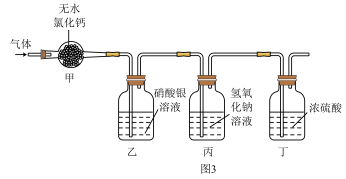
某塑料含有碳、氢元素,可能还含有氧和氯元素中的一种或两种。该塑料充分燃烧除生成二氧化碳和水蒸气外,还可能生成氯化氢气体。取mg该塑料样品与足量干燥的氧气充分反应,用图3所示装置吸收生成的气体。实验过程中,观察到装置乙溶液中产生白色沉淀。当气体被充分吸收后,测得装置甲、乙、丙的质量在反应前后分别增加m1g、m2g和m3g。(无水氯化钙可作干燥剂,装置气密性良好,装置甲、乙、丙、丁中试剂均足量)______ 。
(4)该塑料样品中氢元素的质量为______ (用代数式表示)。
(5)关于该实验,下列说法正确的是______。(填标号)
I、设计氧气的发生装图
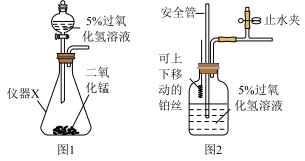
(2)图2中铂丝可催化过氧化氢分解产生氧气。实验过程中,若观察到安全管内液面上升,说明装置内压强过大,此时可以采取的安全措施是
Ⅱ、探究某塑料的组成
某塑料含有碳、氢元素,可能还含有氧和氯元素中的一种或两种。该塑料充分燃烧除生成二氧化碳和水蒸气外,还可能生成氯化氢气体。取mg该塑料样品与足量干燥的氧气充分反应,用图3所示装置吸收生成的气体。实验过程中,观察到装置乙溶液中产生白色沉淀。当气体被充分吸收后,测得装置甲、乙、丙的质量在反应前后分别增加m1g、m2g和m3g。(无水氯化钙可作干燥剂,装置气密性良好,装置甲、乙、丙、丁中试剂均足量)
(4)该塑料样品中氢元素的质量为
(5)关于该实验,下列说法正确的是______。(填标号)
| A.该塑料中碳原子与氯原子的个数比为73m3:88m2 |
| B.若 |
| C.若将装置乙与丙互换,也能够达到实验目的 |
| D.若去除装置丁,则对测定氢元素的质量无影响 |
2023·湖北武汉·中考真题
类题推荐
化学兴趣课上,同学们对过氧化钠(Na2O2)可以做供氧剂产生了浓厚兴趣,于是在老师的指导下展开了以下探究活动。
【提供资料】①二氧化碳与过氧化钠反应生成氧气和另一种物质。
②碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)与盐酸反应均能生成CO2。
③2Na2O2+2H2O=4NaOH+O2↑。
在Na2O2中钠元素为+1价,则根据在化合物中正负化合价代数和为零原则,可计算出此物质中氧元素显_____ 价。
(1)证明二氧化碳与过氧化钠反应产生氧气并收集一瓶氧气。同学们在老师的指导下设计了如下图所示装置。

①a的名称为___________ ,将a与b进行连接的操作是_________ 。
②如何证明氧气已经收集满________ 。
③氢氧化钠溶液的作用是除去未反应的二氧化碳,若观察到________ ,说明二氧化碳已经除尽。
(2)探究二氧化碳与过氧化钠反应生成的另一种物质。
【猜想与假设】下面是同学们提出的3种猜想。
猜想1:是氢氧化钠 猜想2:是碳酸氢钠 猜想3:是碳酸钠
通过对反应物中有关元素的组成分析,华雪认为猜想_____ 是不正确的,理由是_______ 。
【进行实验】同学们通过以下实验验证了另一种物质,请完成下述实验报告。
【反思与评价】若用人呼出的气体通过上图装置,证明二氧化碳与过氧化钠反应生成了氧气,你是否同意这种做法,并阐述理由______ 。
【提供资料】①二氧化碳与过氧化钠反应生成氧气和另一种物质。
②碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)与盐酸反应均能生成CO2。
③2Na2O2+2H2O=4NaOH+O2↑。
在Na2O2中钠元素为+1价,则根据在化合物中正负化合价代数和为零原则,可计算出此物质中氧元素显
(1)证明二氧化碳与过氧化钠反应产生氧气并收集一瓶氧气。同学们在老师的指导下设计了如下图所示装置。

①a的名称为
②如何证明氧气已经收集满
③氢氧化钠溶液的作用是除去未反应的二氧化碳,若观察到
(2)探究二氧化碳与过氧化钠反应生成的另一种物质。
【猜想与假设】下面是同学们提出的3种猜想。
猜想1:是氢氧化钠 猜想2:是碳酸氢钠 猜想3:是碳酸钠
通过对反应物中有关元素的组成分析,华雪认为猜想
【进行实验】同学们通过以下实验验证了另一种物质,请完成下述实验报告。
| 实验操作 | 实验现象 | 实验结论 |
| 取少量CO2与Na2O2反应后的固体于试管中, | 有大量气泡产生,澄清石灰水变浑浊。 | 猜想 |
实验小组用MnO2与浓盐酸反应制取氯气(Cl2),如下图所示。
已知:氯气是黄绿色具有刺激性气味的有毒气体。____ MnO2+_____ HCl
_____ MnCl2+_____ Cl2↑+_____ ______ 。
(2)用向上排空气法收集Cl2,依据Cl2的物理性质是________ 。
(3)NaOH溶液的作用是__________ 。
小组同学发现,反应停止时反应物均有剩余。
【提出问题】反应停止与什么有关呢?
【查阅资料】
Ⅰ.初中常见的酸(如H2SO4、HCl)、碱(如NaOH)及可溶性盐(如NaCl)在水溶液中能完全解离出阳离子和阴离子。例如,HCl在水中能解离出H+和Cl-。
Ⅱ.Cl2能与KI反应置换出I2;淀粉遇I2变蓝,在本实验中作为指示剂,指示I2是否存在。
【提出猜想】
①反应停止与溶液中的Cl-浓度降低到一定程度有关;
②_________。
【进行实验】
为验证猜想,取适量反应后的固液混合物于试管中,分别进行以下实验:
【解释与结论】
(4)猜想②是___________ 。
(5)A中加入的固体是________ 。
(6)B中试纸变蓝的原因是________ 。
【反思与评价】
(7)小组同学认为实验B还不够严谨,原因是________ 。
已知:氯气是黄绿色具有刺激性气味的有毒气体。
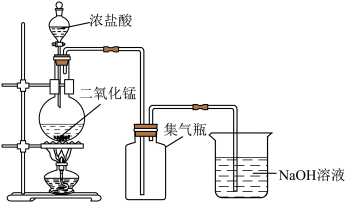
(2)用向上排空气法收集Cl2,依据Cl2的物理性质是
(3)NaOH溶液的作用是
小组同学发现,反应停止时反应物均有剩余。
【提出问题】反应停止与什么有关呢?
【查阅资料】
Ⅰ.初中常见的酸(如H2SO4、HCl)、碱(如NaOH)及可溶性盐(如NaCl)在水溶液中能完全解离出阳离子和阴离子。例如,HCl在水中能解离出H+和Cl-。
Ⅱ.Cl2能与KI反应置换出I2;淀粉遇I2变蓝,在本实验中作为指示剂,指示I2是否存在。
【提出猜想】
①反应停止与溶液中的Cl-浓度降低到一定程度有关;
②_________。
【进行实验】
为验证猜想,取适量反应后的固液混合物于试管中,分别进行以下实验:
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| A | 向试管中加入_____固体,充分振荡后加热,将湿润的淀粉KI试纸置于管口 | 试纸未变蓝 | 猜想①不成立 |
| B | 向试管中滴入2滴浓硫酸,充分振荡后加热,将湿润的淀粉KI试纸置于管口 | 试纸变蓝 | 猜想②成立 |
(4)猜想②是
(5)A中加入的固体是
(6)B中试纸变蓝的原因是
【反思与评价】
(7)小组同学认为实验B还不够严谨,原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


