科学探究题 较难0.4 引用2 组卷97
中考前夕,某市进行化学实验操作考查,请完成下列相关空白。
考查一:第一组同学抽到的题目是“鉴别生活中的食盐和纯碱,并测定食醋的pH”。
(1)请将小组同学的实验记录补充完整:
(2)小张在刷洗试管时,水龙头放出的水将实验台上的pH试纸溅湿,他用该pH试纸测定食醋的酸碱度时,测定的结果会______ (填“偏大”、“偏小”成”不变”)
考查二:第二组同学发现实验台上有氢氧化钡溶液、酚酞溶液以及A、B、C三瓶未贴标签的溶液,老师告诉他们未贴标签的分别是稀硫酸、氯化钡溶液(呈中性)、氢氧化钠溶液。
(3)【实验目的】鉴别A、B、C三种溶液。
【进行实验】甲同学取入溶液少量于试管中,按图示进行实验,据图问答问题:

【初步结论】A一定不是______ 。
【完善方案】乙同学向实验后的溶液中滴加酚酞溶液,酚酞溶液由无色变为红色,乙同学认为A一定是氢氧化钠溶液。丙同学认为乙的结论不够严谨,他的理由是______ 。于是,丙同学又找到了另一种实验台上设有的试剂,利用该试剂,很快鉴别出A物质。请补充他的实验步骤、现象及结论:另取A少量于试管中,______ 。丁同学认为无需借助任何试剂,仅利用三种待测溶液,他便能在甲同学结论的基础上,通过实验鉴别出A.写出他的实验步骤、现象及结论______ 。
【最终结论】在小组同学的共同努力下,最终鉴别出三瓶溶液,并贴上标签。
【实验反思】小聪认为鉴别上述三种溶液不必如此麻烦,分别加入某种试剂即可一次性鉴别,他选择的试剂是______ 。
考查一:第一组同学抽到的题目是“鉴别生活中的食盐和纯碱,并测定食醋的pH”。
(1)请将小组同学的实验记录补充完整:
操作步骤 | 现象记录 | 实验结论 |
取两支试管,分别加入一匙待测样品, 再向其中滴入少量稀盐酸 | 样品1:无明显现象 | / |
样品2:出现气泡 | 该待测样品为 |
考查二:第二组同学发现实验台上有氢氧化钡溶液、酚酞溶液以及A、B、C三瓶未贴标签的溶液,老师告诉他们未贴标签的分别是稀硫酸、氯化钡溶液(呈中性)、氢氧化钠溶液。
(3)【实验目的】鉴别A、B、C三种溶液。
【进行实验】甲同学取入溶液少量于试管中,按图示进行实验,据图问答问题:

【初步结论】A一定不是
【完善方案】乙同学向实验后的溶液中滴加酚酞溶液,酚酞溶液由无色变为红色,乙同学认为A一定是氢氧化钠溶液。丙同学认为乙的结论不够严谨,他的理由是
【最终结论】在小组同学的共同努力下,最终鉴别出三瓶溶液,并贴上标签。
【实验反思】小聪认为鉴别上述三种溶液不必如此麻烦,分别加入某种试剂即可一次性鉴别,他选择的试剂是
2023·辽宁辽阳·三模
类题推荐
化学老师交给某研究性学习小组一个任务:测定实验室里一瓶久置的氢氧化钠是否变质。该小组的同学进行了如下实验探究:
【猜想与假设】
猜想I:没有变质,全部是_________ ;
猜想II:部分变质,既含有氢氧化钠又含有碳酸钠;
猜想III:完全变质,全部是碳酸钠。
【查阅资料】
i:已知信息:BaCl2+Na2CO3=2NaCl+BaCO3↓
Ba(OH)2+Na2CO3=2NaOH+BaCO3↓
ii:部分盐溶液在常温下的PH如下:
【设计方案并进行实验】
请你与他们一起共同完成,并回答所给问题:
滴加过量BaCl2溶液的目的是________ 。
【实验结论】
通过实验,说明上述猜想中________ (填“猜想I”、“猜想II”或“ 猜想III”)是正确的。
【反思】
久置氢氧化钠变质的原因是________ (用化学方程式表示)。
【提升】
能否通过取适量固体样品溶于水,然后滴加几滴酚酞试液的方法判定氢氧化钠是否变质:_______ (填“能”或“不能”),理由是________ 。
【拓展】
该小组同学为测定出该NaOH固体的变质程度,继续将上述实验中的白色沉淀过滤、洗净、干燥,称得其质量为9.85g,则原试剂中NaOH的质量分数为_____ ?(假设氢氧化钠固体中无其他杂质,忽略实验损耗。写出计算过程,计算结果保留至0.1%。)。
【猜想与假设】
猜想I:没有变质,全部是
猜想II:部分变质,既含有氢氧化钠又含有碳酸钠;
猜想III:完全变质,全部是碳酸钠。
【查阅资料】
i:已知信息:BaCl2+Na2CO3=2NaCl+BaCO3↓
Ba(OH)2+Na2CO3=2NaOH+BaCO3↓
ii:部分盐溶液在常温下的PH如下:
| 稀溶液 | NaCl | Na2CO3 | BaCl2 |
| PH | 等于7 | 大于7 | 等于7 |
请你与他们一起共同完成,并回答所给问题:
| 实验步骤 | 实验现象 | 实验结论 |
| ①称取上述氢氧化钠固体样品10.00g溶于50ml水配成溶液,向溶液中滴加氯化钡溶液至过量,充分反应,静置 | 说明久置固体中,一定含有Na2CO3 | |
| ②用 | PH=11 | 说明久置固体中,还一定含有 |
【实验结论】
通过实验,说明上述猜想中
【反思】
久置氢氧化钠变质的原因是
【提升】
能否通过取适量固体样品溶于水,然后滴加几滴酚酞试液的方法判定氢氧化钠是否变质:
【拓展】
该小组同学为测定出该NaOH固体的变质程度,继续将上述实验中的白色沉淀过滤、洗净、干燥,称得其质量为9.85g,则原试剂中NaOH的质量分数为
馒头、面包等发面食品在制作时都需使用发酵粉,发酵粉的主要成分最常见的是碳酸钠、碳酸氢钠等。某兴趣小组的同学对制作馒头用的发酵粉(白色粉末)进行探究。
【提出问题】白色粉末成分是什么?
【进行猜想】猜想Ⅰ:碳酸钠; 猜想Ⅱ:碳酸氢钠; 猜想Ⅲ:_____ 。
【初步探究】取少量白色粉末于试管中,加适量水,测得溶液的 pH=10.5,说明溶液呈_____ 性。
【查阅资料】
(1)碳酸氢钠受热易分解,该反应可表示为 ;而碳酸钠很稳定,受热不易分解。
;而碳酸钠很稳定,受热不易分解。
(2)参照实验:
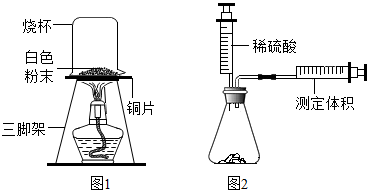
【实验探究】甲、乙、丙三位同学分别设计三种不同实验方案进行探究。
甲同学方案:如图,取适量发酵粉在铜片上加热,加热一段时间后,观察到烧杯内壁有液滴出现,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到_____ 。甲得出结论:猜想Ⅱ正确。
乙同学方案:
乙得出结论:猜想Ⅲ正确。
丙同学方案:用如图所示,锥形瓶中分别盛有等质量的碳酸钠、碳酸氢钠和发酵粉,再注入等体积、等浓度的足量的稀硫酸,准确测量生成气体的体积。记录如表:
【实验结论】经同学们讨论,最终确认:该发酵粉是碳酸钠和碳酸氢钠的混合物。
【反思应用】
(1)同学们讨论时认为:甲同学方案不严密的原因是_____ 。
(2)乙同学方案中,实验①中加入CaCl2溶液要过量的目的是_____ 。
(3)丙同学方案也能得到正确结论应满足的条件是_____ 。
(4)制作馒头、面包时,将面粉发酵(产生有机酸),再加入适量的碳酸氢钠,可以使馒头、面包松软。原因是_____ 。
(5)将12.0g该白色粉末加热至完全反应,剩余固体的质量为8.9g,计算该白色粉末中Na2CO3的质量分数为_____ 。
【提出问题】白色粉末成分是什么?
【进行猜想】猜想Ⅰ:碳酸钠; 猜想Ⅱ:碳酸氢钠; 猜想Ⅲ:
【初步探究】取少量白色粉末于试管中,加适量水,测得溶液的 pH=10.5,说明溶液呈
【查阅资料】
(1)碳酸氢钠受热易分解,该反应可表示为
(2)参照实验:
| NaHCO3稀溶液 | Na2CO3稀溶液 | |
| 加入稀盐酸 | 产生气泡 | 产生气泡 |
| 加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 |

【实验探究】甲、乙、丙三位同学分别设计三种不同实验方案进行探究。
甲同学方案:如图,取适量发酵粉在铜片上加热,加热一段时间后,观察到烧杯内壁有液滴出现,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到
乙同学方案:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量发酵粉加足量水后形成的无色稀溶液,再加入过量CaCl2溶液,静置。 | 有白色沉淀产生 | 化学方程式 |
| ②再取步骤①的上层清液,加入稀盐酸 | 有气泡冒出 | 该溶液中含 |
乙得出结论:猜想Ⅲ正确。
丙同学方案:用如图所示,锥形瓶中分别盛有等质量的碳酸钠、碳酸氢钠和发酵粉,再注入等体积、等浓度的足量的稀硫酸,准确测量生成气体的体积。记录如表:
| 实验 编号 | 锥形瓶内物质 | 最终得到 CO2 体积/mL | |
| 名称 | 质量/g | ||
| ① | 碳酸钠 | a | V1 |
| ② | 碳酸氢钠 | a | V2 |
| ③ | 发酵粉 | a | V3 |
【实验结论】经同学们讨论,最终确认:该发酵粉是碳酸钠和碳酸氢钠的混合物。
【反思应用】
(1)同学们讨论时认为:甲同学方案不严密的原因是
(2)乙同学方案中,实验①中加入CaCl2溶液要过量的目的是
(3)丙同学方案也能得到正确结论应满足的条件是
(4)制作馒头、面包时,将面粉发酵(产生有机酸),再加入适量的碳酸氢钠,可以使馒头、面包松软。原因是
(5)将12.0g该白色粉末加热至完全反应,剩余固体的质量为8.9g,计算该白色粉末中Na2CO3的质量分数为
学习合金知识后,我们知道了黄铜是铜和锌的合金。在教师的引导下同学们分组对其性质进行了项目式探究。
【任务一】比较合金与纯金属的硬度
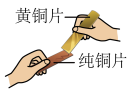
(1)将黄铜片与纯铜片相互刻画(如图),观察到铜片上划痕较深,黄铜片上划痕较浅,据此得出的结论是__________ 。
【任务二】比较黄铜中锌和铜的金属活动性强弱
【查阅资料】锌是银白色有光泽的金属,在空气中,像铝一样,其表面能产生致密的氧化膜。各小组分别设计了如下实验:
(2)比较__________ 两组同学的实验,可以得出打磨能破坏氧化锌薄膜。
(3)乙组同学的实验中发生反应的化学方程式为__________ ,据此可知金属活动性Zn_______ (选填“>”或“<”)Cu。
(4)丙组同学的实验现象引起了大家的讨论。下列是小林同学进行的分析,你认为下列分析合理的是______ (填字母)。
A.H2O破坏了氧化锌薄膜 B.C1-破坏了氧化锌薄膜
C.Cu2+破坏了氧化锌薄膜 D. 破坏了氧化锌薄膜
破坏了氧化锌薄膜
【任务三】比较锌、铜与稀硫酸的反应
(5)小组同学将锌片和铜片分别浸入相同质量、相同质量分数的稀硫酸中。观察到铜片表面无明显现象发生;一段时间后锌片的表面产生大量气泡,氢气的产生速度与反应时间的关系如图所示。
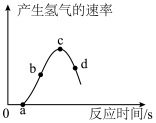
①图中O~a段未产生气体的原因是__________ 。
②b点所对应溶液的pH__________ (选填“大于”、“等于”或“小于”)7.
③c~d段产生氢气的速率下降的主要原因是__________ 。
【任务一】比较合金与纯金属的硬度
(1)将黄铜片与纯铜片相互刻画(如图),观察到铜片上划痕较深,黄铜片上划痕较浅,据此得出的结论是

【任务二】比较黄铜中锌和铜的金属活动性强弱
【查阅资料】锌是银白色有光泽的金属,在空气中,像铝一样,其表面能产生致密的氧化膜。各小组分别设计了如下实验:
| 实验小组 | 实验操作 | 实验现象 |
| 甲 | 将表面未打磨的锌片浸入CuSO4溶液中 | 无明显现象 |
| 乙 | 将表面打磨后的锌片浸入CuSO4溶液中 | 锌片表面析出红色固体 |
| 丙 | 将表面未打磨的锌片浸入CuC12溶液中 | 锌片表面析出红色固体 |
(3)乙组同学的实验中发生反应的化学方程式为
(4)丙组同学的实验现象引起了大家的讨论。下列是小林同学进行的分析,你认为下列分析合理的是
A.H2O破坏了氧化锌薄膜 B.C1-破坏了氧化锌薄膜
C.Cu2+破坏了氧化锌薄膜 D.
【任务三】比较锌、铜与稀硫酸的反应
(5)小组同学将锌片和铜片分别浸入相同质量、相同质量分数的稀硫酸中。观察到铜片表面无明显现象发生;一段时间后锌片的表面产生大量气泡,氢气的产生速度与反应时间的关系如图所示。

①图中O~a段未产生气体的原因是
②b点所对应溶液的pH
③c~d段产生氢气的速率下降的主要原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


