综合应用题 困难0.15 引用1 组卷277
金属及其化合物在生产生活中有广泛的应用。

(1)“航母”舰体材料为合金钢。合金钢是____ (填序号)。
a.合成材料 b.金属材料 c.复合材料
(2)“航母”升降机可由铝合金制造。用石墨作电极在高温条件下电解熔融氧化铝,在阴极和阳极区分别得到Al和O2,阳极区使用的石墨易消耗的原因是________ 。
(3)“航母”螺旋桨可由铜合金制造。铜合金比铜的熔点______ (填“高”或“低”)。
(4)由生铁炼钢时,硅(Si)与氧化亚铁在高温条件下反应生成二氧化硅和铁,该反应属于_______ 反应。
(5)碱式碳酸铝镁Mg6Al2(OH)12CO3•4H2O是一种新型塑料阻燃剂,其受热分解生成熔点较高的MgO和Al2O3,其阻燃原理是______ 。
a.分解吸热,降低可燃物着火点
b.MgO、Al2O3覆盖在可燃物上隔绝氧气
c.分解吸热,可能降低温度至着火点以下
(二)金属及其化合物的利用
聚合碱式氯化铝铁(简称PAFC)【化学式:[FeaAlb(OH)xCly]n】是一种新型的无机高分子絮凝剂。以高铁铝土矿、硫酸厂渣尘为配料M(主要成分:Al2O3、Fe2O3,杂质FeO、二氧化硅等)为原料制取PAFC的实验流程如下:

(6)将配料粉碎的目的是_________ 。
(7)“酸溶”时生成AlCl3的化学方程式为_______ 。滤渣X中含二氧化硅,可以推知二氧化硅具有的下列性质有________ 。
a.不与盐酸反应 b. 不与氢氧化钠溶液反应 c. 难溶于水
(8)“转化”时加入NaClO3溶液使酸性溶液中的FeCl2转化为FeCl3,同时生成NaCl,该转化的化学方程式为_______ 。
(9)“操作”包括过滤、洗涤、干燥,判断产品PAFC已洗涤干净的方法是取_______ 滴入_______ 溶液无现象。
(三)[FeaAlb(OH)xCly]n的组成确定
资料:[FeaAlb(OH)xCly]n受热分解生成氧化铁、氧化铝、水和氯化氢。氢氧化铝可以溶于氢氧化钠溶液。取少量PAFC固体样品,用下图装置进行热分解实验。
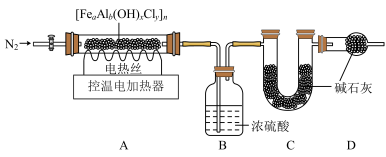
表:装置B和C的质量变化
(10)装配好实验装置后,先要______ ,再加入样品。
(11)反应前后均需要通入N2,反应后通入N2的目的是__________ 。
(12)控制温度对A中固体加热至反应完全
①测得B、C装置质量变化如上表所示。② 取出A中固体,向其中加入足量稀盐酸,完全溶解后,向其中加入过量NaOH溶液,得红褐色沉淀,过滤、洗涤,在空气中充分灼烧得红棕色固体0.80g。
结论:
①[FeaAlb(OH)xCly]n中,a︰b︰x︰y=_______ 。
②完全反应后A中生成氧化铝的质量为_______ 。

(1)“航母”舰体材料为合金钢。合金钢是
a.合成材料 b.金属材料 c.复合材料
(2)“航母”升降机可由铝合金制造。用石墨作电极在高温条件下电解熔融氧化铝,在阴极和阳极区分别得到Al和O2,阳极区使用的石墨易消耗的原因是
(3)“航母”螺旋桨可由铜合金制造。铜合金比铜的熔点
(4)由生铁炼钢时,硅(Si)与氧化亚铁在高温条件下反应生成二氧化硅和铁,该反应属于
(5)碱式碳酸铝镁Mg6Al2(OH)12CO3•4H2O是一种新型塑料阻燃剂,其受热分解生成熔点较高的MgO和Al2O3,其阻燃原理是
a.分解吸热,降低可燃物着火点
b.MgO、Al2O3覆盖在可燃物上隔绝氧气
c.分解吸热,可能降低温度至着火点以下
(二)金属及其化合物的利用
聚合碱式氯化铝铁(简称PAFC)【化学式:[FeaAlb(OH)xCly]n】是一种新型的无机高分子絮凝剂。以高铁铝土矿、硫酸厂渣尘为配料M(主要成分:Al2O3、Fe2O3,杂质FeO、二氧化硅等)为原料制取PAFC的实验流程如下:

(6)将配料粉碎的目的是
(7)“酸溶”时生成AlCl3的化学方程式为
a.不与盐酸反应 b. 不与氢氧化钠溶液反应 c. 难溶于水
(8)“转化”时加入NaClO3溶液使酸性溶液中的FeCl2转化为FeCl3,同时生成NaCl,该转化的化学方程式为
(9)“操作”包括过滤、洗涤、干燥,判断产品PAFC已洗涤干净的方法是取
(三)[FeaAlb(OH)xCly]n的组成确定
资料:[FeaAlb(OH)xCly]n受热分解生成氧化铁、氧化铝、水和氯化氢。氢氧化铝可以溶于氢氧化钠溶液。取少量PAFC固体样品,用下图装置进行热分解实验。

表:装置B和C的质量变化
| 装置 | B | C |
| 反应前/g | 100.00 | 100.00 |
| 反应后/g | 100.18 | 102.92 |
(11)反应前后均需要通入N2,反应后通入N2的目的是
(12)控制温度对A中固体加热至反应完全
①测得B、C装置质量变化如上表所示。② 取出A中固体,向其中加入足量稀盐酸,完全溶解后,向其中加入过量NaOH溶液,得红褐色沉淀,过滤、洗涤,在空气中充分灼烧得红棕色固体0.80g。
结论:
①[FeaAlb(OH)xCly]n中,a︰b︰x︰y=
②完全反应后A中生成氧化铝的质量为
2023·江苏镇江·模拟预测
类题推荐
活动小组为测定由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该固体混合物各20g,分别缓慢加入到50 g、100 g、150 g某稀硫酸中,测得三组实验数据如下表:
根据实验及有关数据进行分析与计算:
(1)第1组实验中_____________ (填“氧化铜”“稀硫酸”或“氧化铜与稀硫酸”)完全反应。
(2)样品中氧化铜的质量分数是__________ g。
(3)根据第1组实验数据计算所用的稀硫酸溶质的质量分数__________ (写出计算过程)。
(4)若将第2组实验后的混合物过滤,在滤液中滴加10%的NaOH溶液,请画出在该混合溶液中加入10% NaOH溶液的质量与生成沉淀质量变化关系的曲线图__________ 。
| 组别 | 第1组 | 第2组 | 第3组 |
| 稀硫酸质量/g | 50 | 100 | 150 |
| 剩余固体的质量/g | 10.0 | 4.0 | 4.0 |
(1)第1组实验中
(2)样品中氧化铜的质量分数是
(3)根据第1组实验数据计算所用的稀硫酸溶质的质量分数
(4)若将第2组实验后的混合物过滤,在滤液中滴加10%的NaOH溶液,请画出在该混合溶液中加入10% NaOH溶液的质量与生成沉淀质量变化关系的曲线图

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网





