综合应用题 较难0.4 引用1 组卷88
某兴趣小组对硫酸铜溶液与烧碱溶液的反应进行了探究。
(1)I.向烧碱溶液中滴加适量硫酸铜溶液,产生蓝色固体,反应的化学方程式为_______ 。
II.向硫酸铜溶液中滴加适量氨水,产生绿色固体,对绿色固体作如下探究:
【资料】常见绿色固体有碱式碳酸铜[Cu2(OH)2CO3]和硫酸[Cu4(OH)6SO4],都不溶于水,都能与酸反应。
【分析】
(2)甲同学认为不可能是Cu2(OH)2CO3,并得到一致认同,理由是______ 。
(3)乙同学进行了实验:取适量绿色固体,加入足量的_______ 溶液,振荡后滴加_______ 溶液,产生白色沉淀,则该固体是碱式硫酸铜。
III.继续滴加氨水,固体逐渐溶解,溶液变蓝色,经处理获得蓝色晶体。
【资料】该蓝色晶体为[Cux(NH3)y(H2O)z]SO4,在150℃下分解为硫酸铜、氨气和水。
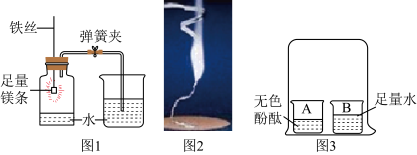
(4)【实验】取264g蓝色晶体用下图装置进行实验探究。
控制温度在150℃持续加热一段时间,并持续通入N2,测得稀硫酸增重68g。停止加热,冷却至室温,加入过量浓NaOH溶液,生成98g沉淀,证明NaOH溶液过量的方法:静置,向上层清液中滴加_______ 溶液,无现象。
【结论】
(5)该蓝色晶体的化学式为________ 。
【讨论】
(6)若实验结束后未持续通N2,则测得[Cux(NH3)y(H2O)z]SO4中y的值______ (选填“偏大”、“偏小”成“不变”)。
(1)I.向烧碱溶液中滴加适量硫酸铜溶液,产生蓝色固体,反应的化学方程式为
II.向硫酸铜溶液中滴加适量氨水,产生绿色固体,对绿色固体作如下探究:
【资料】常见绿色固体有碱式碳酸铜[Cu2(OH)2CO3]和硫酸[Cu4(OH)6SO4],都不溶于水,都能与酸反应。
【分析】
(2)甲同学认为不可能是Cu2(OH)2CO3,并得到一致认同,理由是
(3)乙同学进行了实验:取适量绿色固体,加入足量的
III.继续滴加氨水,固体逐渐溶解,溶液变蓝色,经处理获得蓝色晶体。
【资料】该蓝色晶体为[Cux(NH3)y(H2O)z]SO4,在150℃下分解为硫酸铜、氨气和水。
(4)【实验】取264g蓝色晶体用下图装置进行实验探究。

控制温度在150℃持续加热一段时间,并持续通入N2,测得稀硫酸增重68g。停止加热,冷却至室温,加入过量浓NaOH溶液,生成98g沉淀,证明NaOH溶液过量的方法:静置,向上层清液中滴加
【结论】
(5)该蓝色晶体的化学式为
【讨论】
(6)若实验结束后未持续通N2,则测得[Cux(NH3)y(H2O)z]SO4中y的值
2023·江苏镇江·模拟预测
类题推荐
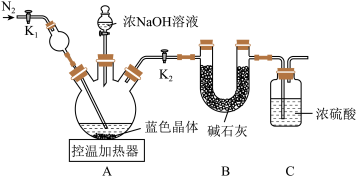
碳还原氧化铜的实验装置如图甲、乙所示,已知浓硫酸具有吸水性。
I、甲图中酒精灯上网罩的作用是____________ 。
【作出猜想】猜想Ⅰ:CO;猜想Ⅱ:CO2;猜想Ⅲ:①_______________ 。
【设计方案】实验装置如图乙所示。打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通入一段时间氮气。
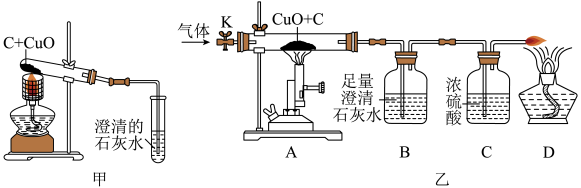
方案一:从定性观察角度判断
②实验时装置A处的现象是___________ 。
③若B中无明显现象,D处的气体能点燃,则猜想_________ (填序号)成立。
方案二:从定量计算角度判断
取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
④若猜想Ⅱ成立,则理论上(m4-m3)_____ (m1-m2)(填“>““<”或“=”)。
⑤若猜想Ⅲ成立且CuO全部转化成Cu,则参加反应的炭粉的质量m的取值范围是_________ 。
【交流反思】实验开始前缓缓通入氮气的目的是________ 。
II、天然气(主要成分为CH4)作为清洁能源,正逐步走进城乡居民生活。
工业上以CH4为原料生产H2,制取原理如图所示:
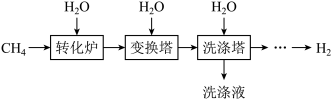
已知变换塔、洗涤塔发生的主要反应依次是:CO+H2O CO2+H2,CO2+H2O═H2CO3。
CO2+H2,CO2+H2O═H2CO3。
(1)“转化炉”中有H2和CO产生,写出转化炉中发生的反应方程式________ ;
(2)“转化炉”参加反应的CH4与H2O的质量比 =
=________ 。(最简整数比)
(3)若有32g CH4参与反应(假设各步反应都完全转化),理论上可制得________ g H2。(写出计算步骤)
I、甲图中酒精灯上网罩的作用是
【作出猜想】猜想Ⅰ:CO;猜想Ⅱ:CO2;猜想Ⅲ:①
【设计方案】实验装置如图乙所示。打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通入一段时间氮气。

方案一:从定性观察角度判断
②实验时装置A处的现象是
③若B中无明显现象,D处的气体能点燃,则猜想
方案二:从定量计算角度判断
取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
| 反应前的质量 | 反应后的质量 | |
| A(玻璃管+固体) | m1 | m2 |
| B+C(广口瓶+混合液) | m3 | m4 |
⑤若猜想Ⅲ成立且CuO全部转化成Cu,则参加反应的炭粉的质量m的取值范围是
【交流反思】实验开始前缓缓通入氮气的目的是
II、天然气(主要成分为CH4)作为清洁能源,正逐步走进城乡居民生活。
工业上以CH4为原料生产H2,制取原理如图所示:

已知变换塔、洗涤塔发生的主要反应依次是:CO+H2O
(1)“转化炉”中有H2和CO产生,写出转化炉中发生的反应方程式
(2)“转化炉”参加反应的CH4与H2O的质量比
(3)若有32g CH4参与反应(假设各步反应都完全转化),理论上可制得
新型冠状病毒肺炎疫情是全球的公共安全事件,当前的重要工作是外防输入,内防反弹。依据研究,含氯消毒剂可以有效灭活新型冠状病毒,为阻断新型冠状病毒疫情做出了巨大贡献。
(1)如图为氯元素的价类二维图。

①二维图中X的化学式为__________ 。
②有一种地康法制取氯气的反应原理如图所示,反应I属于__________ 反应。(填基本反应类型)

(2)探究84消毒液的漂白性。
实验1:取一只 塑料瓶和一个烧杯,分别加入相同大小的一小块棉质红色布条,向塑料瓶装满84消毒液原液,盖紧瓶盖;烧杯中加
塑料瓶和一个烧杯,分别加入相同大小的一小块棉质红色布条,向塑料瓶装满84消毒液原液,盖紧瓶盖;烧杯中加 原液,倒入
原液,倒入 家用白醋。观察有色布条褪色的时间,并作记录,如表。
家用白醋。观察有色布条褪色的时间,并作记录,如表。
表:有色布条褪色时间
实验2:不同温度下,通过实验测得84消毒液的 值,记录如表。
值,记录如表。
表:不同温度下84消毒液的
【信息检索】
a.84消毒液原液呈碱性,主要成分是次氯酸钠( )。漂白的原理是
)。漂白的原理是 与水反应生成次氯酸(
与水反应生成次氯酸( )而具有漂白性,漂白时勿用
)而具有漂白性,漂白时勿用 以上的热水稀释原液。
以上的热水稀释原液。
b.当消毒液 约为10时开始产生次氯酸,随着
约为10时开始产生次氯酸,随着 值减小,次氯酸含量逐渐增加,漂白性逐渐增强。
值减小,次氯酸含量逐渐增加,漂白性逐渐增强。
c. 可衡量84消毒液的漂白能力,
可衡量84消毒液的漂白能力, 数值越大,84消毒液的漂白能力越强。
数值越大,84消毒液的漂白能力越强。
①实验1烧杯中加入醋酸,漂白速率大大加快,原因是__________ 。将塑料瓶装满84消毒液原液后,盖紧瓶盖的原因是__________ 。
②分析表2数据,解释信息检索中“勿用 以上的热水稀释原液”的原因是
以上的热水稀释原液”的原因是__________ 。
③该小组查资料得:“84消毒液”不能与双氧水混合,两者混合会生成氯化钠、水和一种无色无味气体,使其消毒能力大大降低,写出该反应的化学方程式__________ 。
(3)“84”消毒液的制取。
某同学制作了一种84消毒液发生器(如图所示),用石墨作电极,电解饱和氯化钠溶液,即可制得消毒液。实验中,发生的主要反应如下:

I.
Ⅱ.
用 氯气(标准状况下)制备“84消毒液”,至少需要
氯气(标准状况下)制备“84消毒液”,至少需要 的质量是多少?(标准状况下
的质量是多少?(标准状况下 氯气的质量为
氯气的质量为 )
)
(1)如图为氯元素的价类二维图。

①二维图中X的化学式为
②有一种地康法制取氯气的反应原理如图所示,反应I属于

(2)探究84消毒液的漂白性。
实验1:取一只
表:有色布条褪色时间
| 消毒液 | 开始褪色 | 完全褪色 |
| 未加酸 | 5小时 | 48小时 |
| 加酸 | 1分钟 | 15分钟 |
表:不同温度下84消毒液的
| 序号 | 84消毒液与水体积比 | 温度/ | |
| ① | 3 | 608 | |
| ② | 16 | 592 | |
| ③ | 52 | 558 |
a.84消毒液原液呈碱性,主要成分是次氯酸钠(
b.当消毒液
c.
①实验1烧杯中加入醋酸,漂白速率大大加快,原因是
②分析表2数据,解释信息检索中“勿用
③该小组查资料得:“84消毒液”不能与双氧水混合,两者混合会生成氯化钠、水和一种无色无味气体,使其消毒能力大大降低,写出该反应的化学方程式
(3)“84”消毒液的制取。
某同学制作了一种84消毒液发生器(如图所示),用石墨作电极,电解饱和氯化钠溶液,即可制得消毒液。实验中,发生的主要反应如下:

I.
Ⅱ.
用
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网