科学探究题 较难0.4 引用1 组卷98
铜是人类使用最早、应用广泛的金属。
(一)对古代铜制品认识
(1)如图为出土文物古代青铜铸件“雁鱼灯”。该文物能保存至今的原因可能是________________ (选填序号)。

a.铜的活泼性弱,不易生锈 b.深埋于地下,隔绝空气
(2)《吕氏春秋•别类篇》载有“金柔锡柔,合两柔则刚”(注:此处“金”指铜),表明我们的祖先已认识到铜合金的硬度比纯铜________________ (填“大”或“小”)。
(二)铜的化合物制备
辉铜矿主要成分为 Cu 2S、软锰矿主要成分为 MnO2,均含有少量二氧化硅、氧化铁等杂质。工业上综合利用这两种矿物制备碱式碳酸铜的主要工艺流程如图:(已知:①二氧化硅不溶于水,也不溶于酸。② )
)
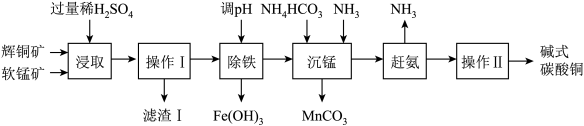
(3)“浸取”前将矿石粉碎成细颗粒的目的是________________ 。
(4)“浸取”时,除氧化铁溶于稀硫酸之外,还会发生反应: , 则“滤渣Ⅰ”中除了有 S 外,一定还有
, 则“滤渣Ⅰ”中除了有 S 外,一定还有 ________________ (写化学式)。
(5)“沉锰”时温度不宜过高,其原因是________________ 。
(6)该流程中可循环利用的物质是________________ 。
(三)碱式碳酸铜的热分解实验
某碱式碳酸铜成分可表示为 Cu X (OH) Y (CO 3) Z,兴趣小组为探究其性质和组成,取 3.46g 样品持续加强热,观察到固体先变成黑色,然后出现红色,同时产生气体。
气体成分的探究
[实验]将生成的气体通入到如图装置。
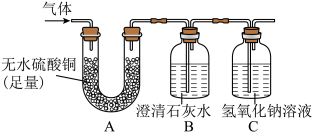
【现象】实验中观察到 A 装置中固体变蓝, B 装置中澄清石灰水变浑浊。
【数据】充分吸收生成的气体后测定,A 装置增重 0.18g ,B 和 C 装置共增重 0.88g。
【计算】
(7)X:Y:Z =________________ 。
红色固体成分的探究
【资料】 1.Cu 和 Cu2O 均为红色固体。2.Cu2O + H2SO4 = CuSO4 + Cu + H2O
【猜想】
(8)红色固体可能是: 猜想 1: Cu; 猜想 2: Cu2O; 猜想 3:________________ 。
【实验】
(9)① 取适量红色固体,加入足量稀硫酸,观察到________________ (填现象) ,则猜想 1 是错误的。
②原 3.46g 样品加强热反应后测得红色固体质量为 2.16g。
【结论】
(10)结合以上数据,写出该碱式碳酸铜分解后的生成物:________________ 。
(一)对古代铜制品认识
(1)如图为出土文物古代青铜铸件“雁鱼灯”。该文物能保存至今的原因可能是

a.铜的活泼性弱,不易生锈 b.深埋于地下,隔绝空气
(2)《吕氏春秋•别类篇》载有“金柔锡柔,合两柔则刚”(注:此处“金”指铜),表明我们的祖先已认识到铜合金的硬度比纯铜
(二)铜的化合物制备
辉铜矿主要成分为 Cu 2S、软锰矿主要成分为 MnO2,均含有少量二氧化硅、氧化铁等杂质。工业上综合利用这两种矿物制备碱式碳酸铜的主要工艺流程如图:(已知:①二氧化硅不溶于水,也不溶于酸。②

(3)“浸取”前将矿石粉碎成细颗粒的目的是
(4)“浸取”时,除氧化铁溶于稀硫酸之外,还会发生反应:
(5)“沉锰”时温度不宜过高,其原因是
(6)该流程中可循环利用的物质是
(三)碱式碳酸铜的热分解实验
某碱式碳酸铜成分可表示为 Cu X (OH) Y (CO 3) Z,兴趣小组为探究其性质和组成,取 3.46g 样品持续加强热,观察到固体先变成黑色,然后出现红色,同时产生气体。
气体成分的探究
[实验]将生成的气体通入到如图装置。

【现象】实验中观察到 A 装置中固体变蓝, B 装置中澄清石灰水变浑浊。
【数据】充分吸收生成的气体后测定,A 装置增重 0.18g ,B 和 C 装置共增重 0.88g。
【计算】
(7)X:Y:Z =
红色固体成分的探究
【资料】 1.Cu 和 Cu2O 均为红色固体。2.Cu2O + H2SO4 = CuSO4 + Cu + H2O
【猜想】
(8)红色固体可能是: 猜想 1: Cu; 猜想 2: Cu2O; 猜想 3:
【实验】
(9)① 取适量红色固体,加入足量稀硫酸,观察到
②原 3.46g 样品加强热反应后测得红色固体质量为 2.16g。
【结论】
(10)结合以上数据,写出该碱式碳酸铜分解后的生成物:
22-23九年级下·江苏无锡·阶段练习
类题推荐
PLA是一种新型可降解塑料,能有效缓解塑料垃圾造成的白色污染。已知PLA由碳、氢、氧三种元素组成,为了测定7.2gPLA样品氧元素的质量,某化学兴趣小组进行了以下探究。
【实验设计】查阅资料,无水硫酸铜遇水由白色变成蓝色。
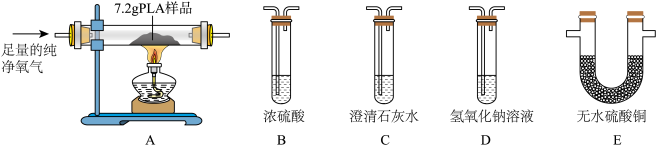
将7.2gPLA样品充分燃烧,为分别吸收燃烧产物并通过清晰可见的现象检验吸收是否完全,以上实验装置正确的连接顺序是:A→______ →_____ →______ →_______ (填写装置的字母序号)。
【分析与结论】
①实验中选择纯净的氧气而不用空气的原因是____________________________ 。
②装置E的作用是______________________ 。
③正确连接装置后,确认气密性良好.充分燃烧7.2gPLA样品,测得相关实验数据见下表(已知燃烧产物被完全吸收,灰烬质量忽略不计)。
通过分析与计算,可知7.2gPLA样品中含有氧元素的质量为_____ 克,该PLA样品中碳、氢、氧三种元素的原子个数最简整数比为___________ 。
【实验设计】查阅资料,无水硫酸铜遇水由白色变成蓝色。

将7.2gPLA样品充分燃烧,为分别吸收燃烧产物并通过清晰可见的现象检验吸收是否完全,以上实验装置正确的连接顺序是:A→
【分析与结论】
①实验中选择纯净的氧气而不用空气的原因是
②装置E的作用是
③正确连接装置后,确认气密性良好.充分燃烧7.2gPLA样品,测得相关实验数据见下表(已知燃烧产物被完全吸收,灰烬质量忽略不计)。
通过分析与计算,可知7.2gPLA样品中含有氧元素的质量为
| 装置 | B | C | D | E |
| 实验前质量/g | 160 | 150 | 150 | 100 |
| 实验后质量/g | 163.6 | 150 | 163.2 | 100 |
2020 年 1 月 25 日总建筑面积为 3.39 万平方米的火神山医院正式开工,在抗击新冠疫情中作出了很大的贡献。火神山医院在建造过程中用到了 HDPE 膜,HDPE 膜具有极好的抗冲击性和防潮性,某探究小组对 HDPE 膜的组成元素进行了如下探究。
[提出问题]HDPE 膜由什么元素组成?
[查阅资料]①HDPE 膜能够燃烧,燃烧可能生成一氧化碳;
②碱石灰主要成分是氢氧化钠固体和氧化钙固体,可作为干燥剂,也可吸收二氧化碳;
③浓硫酸具有吸水性。
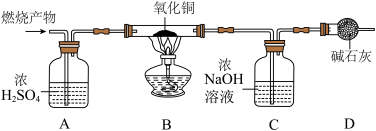
[实验探究]如图所示,先通入氮气一段时间后分别测定 A、C 装置的总质量;再将 8.4g 的 HDPE 膜样品在一定质量的氧气中点燃,点燃 B 处的酒精灯并将燃烧产物依次通过装置 A、B、C、D;最后再通入氮气一段时间后,熄灭 B 处的酒精灯,再次分别测定 A、C 装置的总质量。
[实验记录]
[实验分析]
(1)通入燃烧产物前,先通入氮气的作用是______ 。
(2)装置 D 的作用是______ 。
(3)能证明产物有一氧化碳的实验现象是______ 。
(4)最后再通入氮气一段时间的作用是______ 。
[实验结论]
(5)8.4g 的 HDPE 膜样品中碳元素的质量为______ g,氢元素的质量为______ g,所以 HDPE 膜由碳元素和氢元素组成。
[反思拓展]
(6)若实验中的 8.4 g HDPE 膜样品燃烧的产物为 CO 和 H2O,则消耗的氧气质量为______ g。
[提出问题]HDPE 膜由什么元素组成?
[查阅资料]①HDPE 膜能够燃烧,燃烧可能生成一氧化碳;
②碱石灰主要成分是氢氧化钠固体和氧化钙固体,可作为干燥剂,也可吸收二氧化碳;
③浓硫酸具有吸水性。
[实验探究]如图所示,先通入氮气一段时间后分别测定 A、C 装置的总质量;再将 8.4g 的 HDPE 膜样品在一定质量的氧气中点燃,点燃 B 处的酒精灯并将燃烧产物依次通过装置 A、B、C、D;最后再通入氮气一段时间后,熄灭 B 处的酒精灯,再次分别测定 A、C 装置的总质量。

[实验记录]
装置质量 | A装置总质量 | C装置总质量 |
实验前 | 100.0g | 100.0g |
实验后 | 110.8g | 126.4g |
(1)通入燃烧产物前,先通入氮气的作用是
(2)装置 D 的作用是
(3)能证明产物有一氧化碳的实验现象是
(4)最后再通入氮气一段时间的作用是
[实验结论]
(5)8.4g 的 HDPE 膜样品中碳元素的质量为
[反思拓展]
(6)若实验中的 8.4 g HDPE 膜样品燃烧的产物为 CO 和 H2O,则消耗的氧气质量为
某化学小组同学查阅资料后获知甲烷也具有还原性,于是在实验室里尝试利用甲烷和氧化铜反应。反应后黑色固体全部变红,同学们对除固体以外的其它产物进行如下探究。
【提出假设】
假设①:CO、CO2假设②:CO2、H2O
假设③:CO、H2O假设④:CO、CO2、H2O
(1)其中假设_____ (填序号)不合理,理由是_____ 。
【查阅资料】①浓硫酸具有吸水性,可用作干燥剂;②氢氧化钠溶液可吸收二氧化碳。
【设计实验】为了判断其它几种假设的合理性,小王设计了如图装置进行实验。
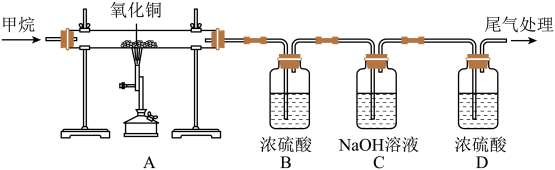
【实验步骤】
①按上图连接装置,并检查装置气密性,称取一定量氧化铜放入硬质玻璃管中;
②通入甲烷一段时间,分别称量B、C、D装置质量后,再点燃酒精喷灯;
③待反应结束,熄灭酒精喷灯,再缓缓通入一段时间甲烷;
④冷却至室温,再次称取B、C、D装置质量,记录数据如下表所示(假设药品均足量)。
【分析与讨论】
(2)步骤③中缓缓通入一段时间甲烷的目的是_____ (任写一点)。
(3)若只称量C装置的增重,则测定CO2的质量会_____ (填“偏大”或者“偏小”)。
(4)由以上数据可推测,假设_____ (填序号)合理,写出该反应的化学方程式_____ 。
【提出假设】
假设①:CO、CO2假设②:CO2、H2O
假设③:CO、H2O假设④:CO、CO2、H2O
(1)其中假设
【查阅资料】①浓硫酸具有吸水性,可用作干燥剂;②氢氧化钠溶液可吸收二氧化碳。
【设计实验】为了判断其它几种假设的合理性,小王设计了如图装置进行实验。

【实验步骤】
①按上图连接装置,并检查装置气密性,称取一定量氧化铜放入硬质玻璃管中;
②通入甲烷一段时间,分别称量B、C、D装置质量后,再点燃酒精喷灯;
③待反应结束,熄灭酒精喷灯,再缓缓通入一段时间甲烷;
④冷却至室温,再次称取B、C、D装置质量,记录数据如下表所示(假设药品均足量)。
| 装置编号 | B | C+D |
| 实验前装置的质量/g | 156.6 | 256.8 |
| 实验后装置的质量/g | 171 | 270 |
(2)步骤③中缓缓通入一段时间甲烷的目的是
(3)若只称量C装置的增重,则测定CO2的质量会
(4)由以上数据可推测,假设
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


