科学探究题 适中0.65 引用2 组卷161
在学习了常见的酸和碱后,某化学兴趣小组的同学围绕“酸碱中和反应”,在老师引导下开展实验探究活动,请你参与下列活动。
(1)运输化学药品浓硫酸的车辆,应该张贴的标志为___________。
【实验探究】将氢氧化钾溶液与稀硫酸混合,观察不到明显现象,为证明氢氧化钾溶液与稀硫酸发生了反应,三位同学进行了以下实验。
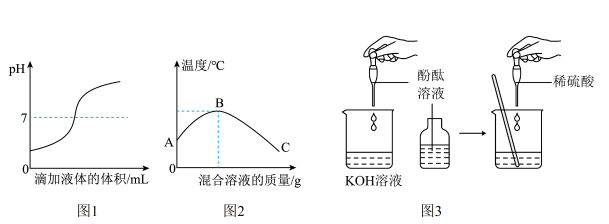
(2)测定溶液pH变化的方法:甲同学在实验过程中测得pH变化如图1所示,则该同学是将___________ (填字母)。
a.稀硫酸滴入氢氧化钾溶液中 b.氢氧化钾溶液滴入稀硫酸中
(3)测混合过程中的温度变化:乙同学在实验过程中测得反应混合溶液的温度变化如图2所示,说明稀硫酸与氢氧化钾溶液发生的反应是___________ (填“放热”或“吸热”)反应。
借助于酸碱指示剂:丙同学通过图3所示,探究稀硫酸和氢氧化钾溶液的反应实验:
(4)根据上述实验中的现象,可确定稀硫酸和氢氧化钾溶液发生了化学反应,反应的化学方程式为___________ 。
【提出问题】针对反应后溶液中溶质的成分,大家纷纷提出了猜想。
【猜想与假设】猜想一:只有K2SO4;
猜想二:有K2SO4和H2SO4;
猜想三:有K2SO4和KOH。
【进行实验】
(5)为了验证猜想,学习小组选用CuO粉末、Ba(NO3)2溶液,进行如下探究:
【实验结论】通过探究,同学们一致确定猜想二是正确的。
【评价与反思】
(6)丁同学针对上述方案提出疑问,认为方案二是不合理的,理由是___________ 。
(7)同学们经过反思与讨论,最后认为方案一中的CuO粉末可以用下列的某些物质代替,也能得到同样的实验结论,请你选出不可代替的药品字母序号:___________。
(8)分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还要考虑___________ 。
(1)运输化学药品浓硫酸的车辆,应该张贴的标志为___________。
A. | B. |
C. | D. |
【实验探究】将氢氧化钾溶液与稀硫酸混合,观察不到明显现象,为证明氢氧化钾溶液与稀硫酸发生了反应,三位同学进行了以下实验。

(2)测定溶液pH变化的方法:甲同学在实验过程中测得pH变化如图1所示,则该同学是将
a.稀硫酸滴入氢氧化钾溶液中 b.氢氧化钾溶液滴入稀硫酸中
(3)测混合过程中的温度变化:乙同学在实验过程中测得反应混合溶液的温度变化如图2所示,说明稀硫酸与氢氧化钾溶液发生的反应是
借助于酸碱指示剂:丙同学通过图3所示,探究稀硫酸和氢氧化钾溶液的反应实验:
(4)根据上述实验中的现象,可确定稀硫酸和氢氧化钾溶液发生了化学反应,反应的化学方程式为
【提出问题】针对反应后溶液中溶质的成分,大家纷纷提出了猜想。
【猜想与假设】猜想一:只有K2SO4;
猜想二:有K2SO4和H2SO4;
猜想三:有K2SO4和KOH。
【进行实验】
(5)为了验证猜想,学习小组选用CuO粉末、Ba(NO3)2溶液,进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 实验结论 |
| 方案一 | 取少量反应后的溶液于试管中,加入CuO粉末 | 溶液中有H2SO4,猜想二正确 | |
| 方案二 | 取少量反应后的溶液于试管中,滴加Ba(NO3)2溶液 | 产生白色沉淀 | 溶液中有H2SO4,猜想二正确 |
【实验结论】通过探究,同学们一致确定猜想二是正确的。
【评价与反思】
(6)丁同学针对上述方案提出疑问,认为方案二是不合理的,理由是
(7)同学们经过反思与讨论,最后认为方案一中的CuO粉末可以用下列的某些物质代替,也能得到同样的实验结论,请你选出不可代替的药品字母序号:___________。
| A.Cu | B.Fe2O3 | C.Mg | D.Na2CO3 |
(8)分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还要考虑
2023·广东茂名·一模
类题推荐
纯碱是一种重要的化工原料,广泛用于玻璃、造纸、纺织和洗涤剂的生产。某化学兴趣小组对纯碱的制备、性质及用途等开展项目式学习。
任务一了解纯碱的制备——“侯氏制碱法”
“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠和氯化铵(NH4Cl),再加热碳酸氢钠即可制得纯碱。碳酸氢钠溶解度较小,在反应后的溶液中通常以晶体形式析出。
(1)饱和氯化钠溶液吸收的两种气体是_______(填字母序号)。
(2)写出饱和氯化钠溶液吸收(1)中的两种气体生成碳酸氢钠和氯化铵的反应方程式_______ 。
任务二探究纯碱的性质——Na2CO3溶液呈碱性
【查阅资料】①溶液呈碱性,是因为溶液中存在较多的OH-。
②Na2CO3在水中全部解离出Na+和CO 。
。
③CaCl2溶液呈中性,Ca2+、Cl-对溶液的酸碱性没有影响。
【提出猜想】
(3)猜想一:H2O单独起作用,产生较多的OH-,使溶液呈碱性。
猜想二:Na+与H2O作用,产生较多的OH-,使溶液呈碱性。
猜想三:_______ 。
(4)【实验探究】
【解释与结论】同学们和老师交流,得知CO 和H2O作用,产生较多的OH-和另一种阴离子。
和H2O作用,产生较多的OH-和另一种阴离子。
【拓展与延伸】
(5)结合任务二的所有信息和结论,运用初中化学所学知识,经过分析推理可得出:Na2CO3溶液中含有的阴离子是_______ 。
任务三探究纯碱的用途——用于生产洗涤剂
【查阅资料】Na2CO3可用于生产洗涤剂。Na2CO3溶液呈碱性,可清洗油污,溶液碱性越强,去油污效果越好。
【实验探究】兴趣小组继续对影响Na2CO3溶液去油污效果的因素进行探究。
用不同温度的水,配制溶质质量分数分别为2%、6%和10%的Na2CO3溶液,并测定溶液pH,记录数据如表:
【解释与结论】
(6)实验①、②、③对比,可得出的结论是_______ 。
(7)要证明Na2CO3溶液的溶质质量分数变化与pH变化关系,可选择的3个实验的编号是_______ 。
【拓展与应用】
(8)下列物质可用于去油污的是_______(填字母序号)。
任务一了解纯碱的制备——“侯氏制碱法”
“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠和氯化铵(NH4Cl),再加热碳酸氢钠即可制得纯碱。碳酸氢钠溶解度较小,在反应后的溶液中通常以晶体形式析出。
(1)饱和氯化钠溶液吸收的两种气体是_______(填字母序号)。
| A.Cl2 | B.NH3 | C.SO2 | D.CO2 |
任务二探究纯碱的性质——Na2CO3溶液呈碱性
【查阅资料】①溶液呈碱性,是因为溶液中存在较多的OH-。
②Na2CO3在水中全部解离出Na+和CO
③CaCl2溶液呈中性,Ca2+、Cl-对溶液的酸碱性没有影响。
【提出猜想】
(3)猜想一:H2O单独起作用,产生较多的OH-,使溶液呈碱性。
猜想二:Na+与H2O作用,产生较多的OH-,使溶液呈碱性。
猜想三:
(4)【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| (1)向试管中加入一定量的蒸馏水,滴入2滴酚酞溶液 | 溶液无明显变化 | 猜想一不成立 |
| (2)向试管中加入一定量的NaCl溶液,滴入2滴酚酞溶液 | 溶液无明显变化 | 猜想二不成立 |
| (3)①向试管中加入一定量的Na2CO3溶液,滴入2滴酚酞溶液 ②往①所得溶液中逐滴加入CaCl2溶液至过量 | ①溶液由无色变红色 ② | 猜想三成立 |
【解释与结论】同学们和老师交流,得知CO
【拓展与延伸】
(5)结合任务二的所有信息和结论,运用初中化学所学知识,经过分析推理可得出:Na2CO3溶液中含有的阴离子是
任务三探究纯碱的用途——用于生产洗涤剂
【查阅资料】Na2CO3可用于生产洗涤剂。Na2CO3溶液呈碱性,可清洗油污,溶液碱性越强,去油污效果越好。
【实验探究】兴趣小组继续对影响Na2CO3溶液去油污效果的因素进行探究。
用不同温度的水,配制溶质质量分数分别为2%、6%和10%的Na2CO3溶液,并测定溶液pH,记录数据如表:
| 实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
| 溶质质量分数 | 2% | 2% | 2% | 6% | 6% | 6% | 10% | 10% | 10% |
| 溶液温度(℃) | 20 | 40 | 60 | 20 | 50 | 60 | 20 | 40 | 70 |
| 溶液pH | 10.90 | 11.18 | 11.26 | 11.08 | 11.27 | 11.30 | 11.22 | 11.46 | 11.50 |
(6)实验①、②、③对比,可得出的结论是
(7)要证明Na2CO3溶液的溶质质量分数变化与pH变化关系,可选择的3个实验的编号是
【拓展与应用】
(8)下列物质可用于去油污的是_______(填字母序号)。
| A.NaCl | B.NaOH | C.K2CO3 | D.CaCO3 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网




