综合应用题 较难0.4 引用1 组卷85
铜及铜的化合物在生产、生活中有着广泛的应用。
(一)铜的广泛应用
(1)我国在西汉时期就有“曾青(硫酸铜)得铁则化为铜”之说,用化学方程式表示其原理:_______ ,该反应的基本反应类型是_______ 。
(二)硫酸铜晶体的制备
工业上用含铜废料(如:碎铜、电缆皮等)。某化学小组的同学提出可以用含铜废料制备硫酸铜晶体(CuSO4·xH2O).主要流程如下:
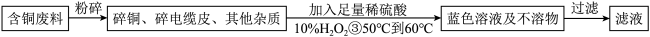
(2)含铜废料粉碎的目的是______ 。
(3)该流程中,加入H2O2后要求温度控制在50℃到60℃加热的原因为______ 。
(4)兴趣小组同学一致指出,将滤液经蒸发浓缩、______ (填结晶方法)、过滤等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体(CuSO4·xH2O),晶体采用酒精淋洗而不用水的原因是______ 。
(三)铜生锈会生成碱式碳酸铜,而工业上所制得的碱式碳酸铜种类较多,其组成表示为:xCuCO3·yCu(OH)2·zH2O。
资料:xCuCO3·yCu(OH)2·zH2O加热至200℃时会分解得到氧化铜,二氧化碳和水。
测定某种产品的组成,该兴趣小组准确称量了25.8g的样品,设计了如下装置并进行实验:
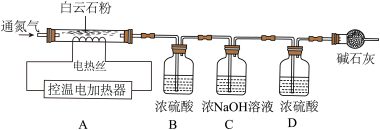
实验数据记录如下表:
实验分析和数据处理
(5)实验前应该先______ ,再鼓入一段时间氮气后称量B、C、D、E的质量。
(6)停止鼓入氮气,调控温电加热220℃持续加热,观察到装置B中______ 时表明碱式碳酸铜已经完全分解。
(7)反应结束后,再缓缓鼓入一段时间氮气的目的是______ 。
(8)该碱式碳酸铜的化学式是_____ 。(写出详细的计算过程)
(一)铜的广泛应用
(1)我国在西汉时期就有“曾青(硫酸铜)得铁则化为铜”之说,用化学方程式表示其原理:
(二)硫酸铜晶体的制备
工业上用含铜废料(如:碎铜、电缆皮等)。某化学小组的同学提出可以用含铜废料制备硫酸铜晶体(CuSO4·xH2O).主要流程如下:
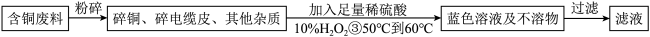
(2)含铜废料粉碎的目的是
(3)该流程中,加入H2O2后要求温度控制在50℃到60℃加热的原因为
(4)兴趣小组同学一致指出,将滤液经蒸发浓缩、
(三)铜生锈会生成碱式碳酸铜,而工业上所制得的碱式碳酸铜种类较多,其组成表示为:xCuCO3·yCu(OH)2·zH2O。
资料:xCuCO3·yCu(OH)2·zH2O加热至200℃时会分解得到氧化铜,二氧化碳和水。
测定某种产品的组成,该兴趣小组准确称量了25.8g的样品,设计了如下装置并进行实验:

实验数据记录如下表:
B中溶液质量/g | C中溶液质量/g | D中溶液质量/g | E中固体质量/g | |
反应前 | 100.0 | 100.0 | 100.0 | 120.5 |
反应后 | 105.4 | 104.2 | 100.2 | 120.5 |
(5)实验前应该先
(6)停止鼓入氮气,调控温电加热220℃持续加热,观察到装置B中
(7)反应结束后,再缓缓鼓入一段时间氮气的目的是
(8)该碱式碳酸铜的化学式是
22-23九年级下·江苏无锡·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网