科学探究题 适中0.65 引用1 组卷46
关于酸的性质是一项重要的课题。某小组以“探究硫酸的性质”为主题开展项目式学习。
【任务一】 浓硫酸稀释过程中的能量变化。
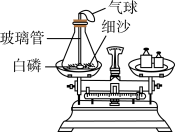
(1)图1实验中,观察到用石蜡固定在铜片下的乒乓球脱落,此现象说明浓硫酸溶于水_____ 。
【任务二】溶液浓度对硫酸化学性质的影响。
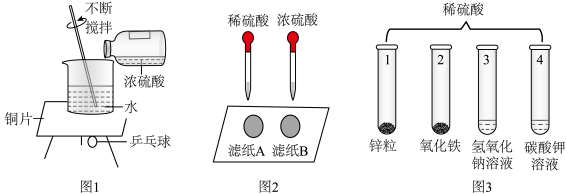
(2)图2实验中,观察到很快变黑的是滤纸______ (填“A”或“B”),由此可知,硫酸溶液的浓度不同,腐蚀性不同。
【任务三】稀硫酸的化学性质。
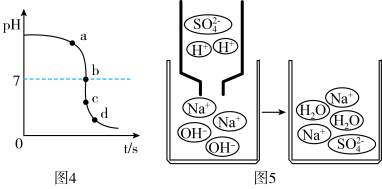
小组同学按图3进行实验。
(3)试管2中可观察到的现象是______ ;反应方程式为_______ 。
(4)该组同学利用数字化传感器测得试管3中不断滴加稀硫酸时pH的变化图像如图4所示,二者恰好完全反应的微观示意图如图5所示。
①图4中a点所示溶液中含有的溶质是______ 。
②该反应的实质是____ 。
小组同学对试管4反应后的物质成分产生了兴趣,继续进行实验。
【提出问题】试管4反应后的溶液中溶质成分是什么?
【作出猜想】
(5)猜想一:可能是K2SO4;猜想二:可能是_______ ;猜想三:可能是K2SO4、H2SO4
【实验与结论】
(6)某同学为验证猜想三,用洁净干燥的玻璃棒蘸取该反应后溶液滴到湿润的pH试纸上,测得pH=4,她认为猜想三正确。对她的操作方法、测量结果及结论的评价,正确的是 。
【任务四】废液回收处理。
(7)实验结束后,在老师指导下同学们将四支试管中的液体倒入废液缸,并对废液缸中的固体物质进行了回收。在检验废液时发现硫酸过量,为防止其污染环境,从实验成本的角度考虑,向该废液中加入适量的______ (填一种具体物质),处理后再排放。


【任务一】 浓硫酸稀释过程中的能量变化。
(1)图1实验中,观察到用石蜡固定在铜片下的乒乓球脱落,此现象说明浓硫酸溶于水
【任务二】溶液浓度对硫酸化学性质的影响。
(2)图2实验中,观察到很快变黑的是滤纸
【任务三】稀硫酸的化学性质。
小组同学按图3进行实验。
(3)试管2中可观察到的现象是
(4)该组同学利用数字化传感器测得试管3中不断滴加稀硫酸时pH的变化图像如图4所示,二者恰好完全反应的微观示意图如图5所示。
①图4中a点所示溶液中含有的溶质是
②该反应的实质是
小组同学对试管4反应后的物质成分产生了兴趣,继续进行实验。
【提出问题】试管4反应后的溶液中溶质成分是什么?
【作出猜想】
(5)猜想一:可能是K2SO4;猜想二:可能是
【实验与结论】
(6)某同学为验证猜想三,用洁净干燥的玻璃棒蘸取该反应后溶液滴到湿润的pH试纸上,测得pH=4,她认为猜想三正确。对她的操作方法、测量结果及结论的评价,正确的是 。
| A.方法不正确,结果偏小,结论正确 |
| B.方法正确,结果偏大,结论不正确 |
| C.方法不正确,结果偏大,结论正确 |
| D.方法正确,结果偏小,结论不正确 |
【任务四】废液回收处理。
(7)实验结束后,在老师指导下同学们将四支试管中的液体倒入废液缸,并对废液缸中的固体物质进行了回收。在检验废液时发现硫酸过量,为防止其污染环境,从实验成本的角度考虑,向该废液中加入适量的
22-23九年级下·江苏无锡·阶段练习
类题推荐
化学兴趣小组在学完常见的酸和碱的性质后,对以下问题进行了探究。
已知:Na2SO4溶液呈中性
(1)探究酸和碱能否发生反应:
方案1:甲同学向盛有少量NaOH溶液的试管中滴几滴无色酚酞试液,振荡,继续滴加稀硫酸。观察到溶液由___________ 色变成无色,该反应的化学方程式为___________ 。甲同学得出结论:酸和碱能发生反应。
方案2:乙同学取少量NaOH溶液,测得溶液pH为10,向该溶液中加入一定量稀硫酸后,测得溶液pH为9.乙同学发现溶液pH减小了,得出结论:酸和碱能发生反应。
【交流讨论】:
(2)大家同意甲同学的结论,对乙同学的实验过程提出质疑,溶液pH减小的原因还可能是___________ 。大家认为,乙同学向NaOH溶液中加入稀硫酸后,测得溶液的pH必须小于或等于7,才能证明酸和碱能发生反应。
探究酸和碱反应后溶液中溶质的成分:
丙同学对探究(1)中甲同学实验后的无色溶液展开探究。
【提出问题】试管中无色溶液的溶质除了酚酞还有什么?
【作出假设】
(3)①Na2SO4②Na2SO4和___________ 。
【设计实验】
(4)
【实验反思】
(5)为了验证猜想②成立,你认为还可以选择的药品是___________(填字母序号)。
已知:Na2SO4溶液呈中性
(1)探究酸和碱能否发生反应:
方案1:甲同学向盛有少量NaOH溶液的试管中滴几滴无色酚酞试液,振荡,继续滴加稀硫酸。观察到溶液由
方案2:乙同学取少量NaOH溶液,测得溶液pH为10,向该溶液中加入一定量稀硫酸后,测得溶液pH为9.乙同学发现溶液pH减小了,得出结论:酸和碱能发生反应。
【交流讨论】:
(2)大家同意甲同学的结论,对乙同学的实验过程提出质疑,溶液pH减小的原因还可能是
探究酸和碱反应后溶液中溶质的成分:
丙同学对探究(1)中甲同学实验后的无色溶液展开探究。
【提出问题】试管中无色溶液的溶质除了酚酞还有什么?
【作出假设】
(3)①Na2SO4②Na2SO4和
【设计实验】
(4)
| 实验操作 | 实验现象 | 实验结论 | |
| 方案1 | 向试管中加入少量锌粒,然后加入甲同学实验后的无色溶液 | 猜想②成立 | |
| 方案2 | 向试管中加入少量甲同学实验后的无色溶液,然后逐滴滴加NaOH溶液,并不断振荡试管 |
【实验反思】
(5)为了验证猜想②成立,你认为还可以选择的药品是___________(填字母序号)。
| A.紫色石蕊溶液 | B.Cu | C.Fe2O3 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网