科学探究题 适中0.65 引用1 组卷3
2010年5月12日,在苍茫海水中沉没了800多年的“南海一号”重见天日,其中的宋代铜钱已经锈迹斑斑。已知:铜绿的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它受热分解的化学方程式为:
某同学设计了如下实验,用来测定碱式碳酸铜受热分解后产生的水和二氧化碳的质量比。
实验用到的主要装置为:
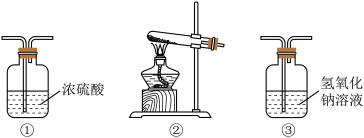
装置连接顺序为_______ 。(填写编号)
(2)操作步骤及数据处理:
第一步 检查气密性;
第二步 装入药品,称取装置①和③的质量;
第三步 试验后再次称取装置①和③的质量,记录数据如表:
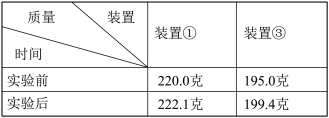
根据以上数据可得产生的水和二氧化碳的质量之比为__________ 。(要求写出最简整数比)
(3)结果分析;从下列选项中选出产生该实验结果可能的原因有哪些?_____
A.二氧化碳没有被完全吸收
B.水没有被完全吸收
C.碱式碳酸铜药品中含有水分
D.碱式碳酸铜没有完全分解
某同学设计了如下实验,用来测定碱式碳酸铜受热分解后产生的水和二氧化碳的质量比。
实验用到的主要装置为:

装置连接顺序为
(2)操作步骤及数据处理:
第一步 检查气密性;
第二步 装入药品,称取装置①和③的质量;
第三步 试验后再次称取装置①和③的质量,记录数据如表:

根据以上数据可得产生的水和二氧化碳的质量之比为
(3)结果分析;从下列选项中选出产生该实验结果可能的原因有哪些?
A.二氧化碳没有被完全吸收
B.水没有被完全吸收
C.碱式碳酸铜药品中含有水分
D.碱式碳酸铜没有完全分解
2017九年级下·江苏·专题练习
类题推荐
下面是兴趣小组同学对暴露在空气的氢氧化钠固体的探究.请回答下列问题:
[提出问题1]: 该氢氧化钠固体有没有变质呢?
[进行实验1]:甲同学取少量固体于试管中用足量的水溶解,后加入过量的 BaCl2 溶液,观察到_________________ ,证明氢氧化钠固体已经含有 Na2CO3.
[提出问题2]:
如何除去氢氧化钠固体中的杂质,得到纯净的氢氧化钠呢?
[进行实验2]:乙同学对该氢氧化钠固体进行提纯,按如下操作流程进行实验.
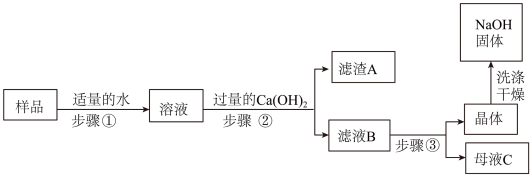
[实验分析]:
⑴步骤②反应的化学方程式是____________ ,步骤②的操作有搅拌和过滤,搅拌的作用是_______ .
⑵证明步骤②中已达到 Ca(OH)2溶液过量的目的,下列方案中可行的是_________ .
a.取少量滤液 B,向其中通二氧化碳气体,溶液变浑浊
b.取少量溶液 B,向其中再加少量石灰水,无白色浑浊
c.取少量溶液 B,向其中再加少量浓碳酸钠溶液,有白色浑浊
⑶为获得纯净的氢氧化钠步骤③所包含的具体操作是蒸发浓缩、_________ 、过滤. A.蒸发结晶B.降温结晶
⑷丙同学认为乙同学流程中的 Ca(OH)2 溶液可以用稍过量的 Ba(OH)2 溶液代替,代替后的主要优点是_______________ .
A.氢氧化钙微溶于水,氢氧化钡易溶于水,用氢氧化钡溶液可以减少溶液中水的量,以提高蒸发浓缩的效率,并节约能源.
B.只有氢氧化钡才能除去杂质
[实验拓展]:如何测定久置的烧碱样品中氢氧化钠的质量分数呢?
从一瓶久置的烧碱中称取了 20g,干燥后剩余固体固体质量为 19g,完全溶于蒸馏水 中配成 100g 样品溶液,现取一定溶质的质量分数的氯化钡溶液与样品溶液混合,充分反 应后得到如表所示的数据.
⑸表中第_________ 次恰好完全反应.
⑹请计算样品中氢氧化钠的质量分数为_____________ ?(请写具体解题过程)
[提出问题1]: 该氢氧化钠固体有没有变质呢?
[进行实验1]:甲同学取少量固体于试管中用足量的水溶解,后加入过量的 BaCl2 溶液,观察到
[提出问题2]:
如何除去氢氧化钠固体中的杂质,得到纯净的氢氧化钠呢?
[进行实验2]:乙同学对该氢氧化钠固体进行提纯,按如下操作流程进行实验.

[实验分析]:
⑴步骤②反应的化学方程式是
⑵证明步骤②中已达到 Ca(OH)2溶液过量的目的,下列方案中可行的是
a.取少量滤液 B,向其中通二氧化碳气体,溶液变浑浊
b.取少量溶液 B,向其中再加少量石灰水,无白色浑浊
c.取少量溶液 B,向其中再加少量浓碳酸钠溶液,有白色浑浊
⑶为获得纯净的氢氧化钠步骤③所包含的具体操作是蒸发浓缩、
⑷丙同学认为乙同学流程中的 Ca(OH)2 溶液可以用稍过量的 Ba(OH)2 溶液代替,代替后的主要优点是
A.氢氧化钙微溶于水,氢氧化钡易溶于水,用氢氧化钡溶液可以减少溶液中水的量,以提高蒸发浓缩的效率,并节约能源.
B.只有氢氧化钡才能除去杂质
[实验拓展]:如何测定久置的烧碱样品中氢氧化钠的质量分数呢?
从一瓶久置的烧碱中称取了 20g,干燥后剩余固体固体质量为 19g,完全溶于蒸馏水 中配成 100g 样品溶液,现取一定溶质的质量分数的氯化钡溶液与样品溶液混合,充分反 应后得到如表所示的数据.
| 项目和次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 |
| 样品溶液质量(g) | 10 | 20 | 30 | 40 |
| 氯化钡溶液质量(g) | 10 | 15 | 15 | 30 |
| 产生沉淀的质量(g) | 1.97 | 3.94 | 3.94 | X |
⑹请计算样品中氢氧化钠的质量分数为
金属锌在生产生活中有广泛应用。
Ⅰ、生活中人们常使用的“五号电池”属于锌锰电池,电池内部结构如图 1 所示。

[查阅资料] ①锌皮为金属锌(含有少量的铁)。
②黑色糊状填充物由炭黑、MnO2、ZnCl2、NH4Cl 等组成
③NH4Cl 和 ZnCl2的溶解度数据见下表:
按照图 2 所示实验回收黑色糊状填充物中的部分物质。
(1)溶液 A 中溶质主要有______ (填化学式),操作Ⅱ中采用冷却热饱和溶液的方法实现两者的分离,得到的固体 N 是______ (填化学式)。
(2)欲从固体 M 中得到较纯的 MnO2,操作Ⅲ可采用的方法是______ 。
Ⅱ、小明用纯锌粒和稀盐酸反应制取氢气时,发现加入 CuSO4溶液后,反应速率明显变大,于是他对此反应速率变大的原因进行了实验探究。
【猜想】①加入的 CuSO4溶液中的 使反应速率变大
使反应速率变大
②加入的 CuSO4溶液中的H2O 使反应速率变大
③加入的 CuSO4溶液中的 Cu2+使反应速率变大
④加入 CuSO4溶液后,______ 使反应速率变大。
小明经过思考,认为最不可能的原因是猜想②。
【实验验证】
用 a、b、c、d 四支试管取等质量且过量的纯锌粒,分别向试管中加入等体积等溶质质量分数的稀盐酸后,继续以下实验:
【结论】在锌与稀盐酸反应时,加入铜粉或______ 可加快反应速率。
Ⅲ、尝试定量探究实验
分别用 5 支烧杯各取该稀盐酸 50.00 g,加入锌粒。反应 4 小时后,发现烧杯中锌粒仍在冒气泡。相关数据如下表:
根据以上数据计算实验①参加反应的锌粒质量。______ (写出计算过程,结果精确到 0.01g)
若分别计算实验①②③④中参加反应的锌粒质量并分析计算结果,发现有明显偏差,其可能原因是______ 。
Ⅰ、生活中人们常使用的“五号电池”属于锌锰电池,电池内部结构如图 1 所示。

[查阅资料] ①锌皮为金属锌(含有少量的铁)。
②黑色糊状填充物由炭黑、MnO2、ZnCl2、NH4Cl 等组成
③NH4Cl 和 ZnCl2的溶解度数据见下表:
| 温度/C | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 | |
(1)溶液 A 中溶质主要有
(2)欲从固体 M 中得到较纯的 MnO2,操作Ⅲ可采用的方法是
Ⅱ、小明用纯锌粒和稀盐酸反应制取氢气时,发现加入 CuSO4溶液后,反应速率明显变大,于是他对此反应速率变大的原因进行了实验探究。
【猜想】①加入的 CuSO4溶液中的
②加入的 CuSO4溶液中的H2O 使反应速率变大
③加入的 CuSO4溶液中的 Cu2+使反应速率变大
④加入 CuSO4溶液后,
小明经过思考,认为最不可能的原因是猜想②。
【实验验证】
用 a、b、c、d 四支试管取等质量且过量的纯锌粒,分别向试管中加入等体积等溶质质量分数的稀盐酸后,继续以下实验:
| 实验 | 现象 | 结论 |
| (1)向a试管中加入少量NaCl晶体 | 产生气泡速率不变 | |
| (2)向b试管中加入少量 | 产生气泡速率不变 | 猜想①不成立 |
| (3)向c试管中加入少量Cu粉 | 产生气泡速率明显变大 | 猜想 |
| (4)向d试管中加入少量Cu粉,立即再加入CuSO4粉末 | 产生气泡速率与c试管的速率几乎一样大 | 猜想 |
Ⅲ、尝试定量探究实验
分别用 5 支烧杯各取该稀盐酸 50.00 g,加入锌粒。反应 4 小时后,发现烧杯中锌粒仍在冒气泡。相关数据如下表:
| 平行实验 | ① | ② | ③ | ④ | ⑤ | |
| 反应前质量/g | 锌粒 | 5.75 | 5.77 | 5.79 | 5.77 | 5.75 |
| 烧杯 | 75.17 | 76.36 | 70.16 | 74.73 | 70.14 | |
| 反应4h后质量/g | 烧杯及烧杯内所有物质 | 128.96 | 130.13 | 123.99 | 128.51 | 123.93 |
若分别计算实验①②③④中参加反应的锌粒质量并分析计算结果,发现有明显偏差,其可能原因是
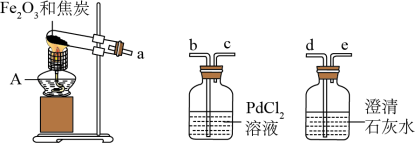
早在春秋战国时期,我国就开始生产和使用铁器。某实验小组利用焦炭和Fe2O3模拟早期炼铁并检验可能的产物,实验装置如下:
【查阅资料】①铁粉为黑色:常温下,Fe可被磁铁吸引。
②溶液可用于检验CO,原理是: 。
。
③Fe3O4与硫酸反应: 。
。
【实验现象】澄清石灰水变浑浊,溶液中产生黑色沉淀,玻璃管内粉末全部变成黑色。冷却后,用磁铁靠近黑色固体,黑色固体被部分吸引。
(1)仪器A的名称是_____________ 。
(2)为了检验气体产物,装置从左到右的接口连接顺序为a→d→e→_______ →___________ 。
(3)澄清石灰水变浑浊的化学方程式___________ 。
【实验结论】反应生成CO和___________ 。磁铁上的黑色固体可能是Fe。
【提出猜想】磁铁上的黑色固体是什么?
猜想一:Fe;猜想二:___________ ;猜想三:Fe、___________ 。
【设计实验】
【归纳总结】根据实验结论和探究结果反应的化学方程式为_____ 。

【查阅资料】①铁粉为黑色:常温下,Fe可被磁铁吸引。
②溶液可用于检验CO,原理是:
③Fe3O4与硫酸反应:
【实验现象】澄清石灰水变浑浊,溶液中产生黑色沉淀,玻璃管内粉末全部变成黑色。冷却后,用磁铁靠近黑色固体,黑色固体被部分吸引。
(1)仪器A的名称是
(2)为了检验气体产物,装置从左到右的接口连接顺序为a→d→e→
(3)澄清石灰水变浑浊的化学方程式
【实验结论】反应生成CO和
【提出猜想】磁铁上的黑色固体是什么?
猜想一:Fe;猜想二:
【设计实验】
| 设计思路 | 操作 | 现象 | 结论 |
| 定性实验 | 取少量磁铁上黑色固体于试管中,加入足量稀硫酸,充分反应 | 猜想二不成立 | |
| 定量实验 | 取足量的稀硫酸放入烧杯中,加入5.6g磁铁上黑色固体,充分反应后称量溶液的质量 | 固体完全溶解,产生气泡,溶液增加的质量为5.4g | 猜想 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


