综合应用题 较难0.4 引用1 组卷101
金属及其化合物在生产生活中应用广泛。
(一)金属的性质和应用
(1)人类使用金属先后经历了:“青铜”、“铁器”时代,近代才开始大量使用铝材料。这也反映出Cu、Fe、Al三种金属的活动性不同,其由强到弱的顺序是___________ 。
(2)我国西汉就有“曾青得铁则化为铜”之说,用化学方程式表示其原理___________ 。
(3)铁生锈主要与空气中的___________ 有关。
(4)如图实验说明NaC1在铁生锈中的作用是___________ 。

铁生锈的主要过程为:

(5)写出 的化学方程式
的化学方程式___________ 。
(6)铁锈中一定含Fe2O3.nH2O,可能含FeCO3(FeCO3和稀HCl的反应与CaCO3相似),在某铁锈样品中加稀HCl,___________ (填现象),证明不含FeCO3.
(二)铁的化合物制备
用废铁屑制备铁红(主要成分为Fe2O3)的部分流程如下图所示:
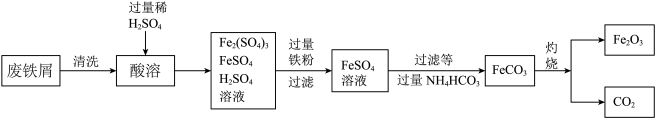
(7)清洗时利用洗涤剂的___________ 作用,用其除废铁屑表面的油污。
(8)流程中加入的铁粉除和H2SO4反应外,还和Fe2(SO4)3发生化合反应,此化合反应的化学方程式为___________ 。
(9)加过量NH4HCO3反应时温度不宜过高的原因为___________ 。
(10)在空气中灼烧FeCO3的反应为___________ (写化学方程式)。
(三)CH4还原Fe2O3的探究
取48.0gFe2O3粉末,用下图装置进行实验,并对反应及产物等作探究。
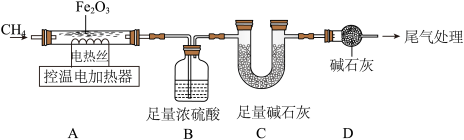
资料:①浓硫酸有吸水性,碱石灰可吸收H2O和CO2.② 。
。
(11)装配好实验装置后,先要___________ 。
(12)加热前后及过程中均通入CH4,停止加热后继续通CH4的目的是防止倒吸和___________ 。
(13)A中有如下反应: ,下列说法正确的是
,下列说法正确的是___________ (填序号)。
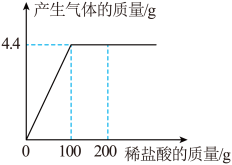
a、y=2x b、装置B、C增加的质量比为9:22
(14)控温加热一段时间后,继续通CH4至冷却,A中剩余的35.2g固体为Fe和FeO的混合物。在剩余固体中加一定量硫酸溶液,反应刚好完全。
①剩余固体中FeO质量为___________ g。
②剩余固体和稀硫酸完全反应形成FeSO4的质量为___________ g。
(一)金属的性质和应用
(1)人类使用金属先后经历了:“青铜”、“铁器”时代,近代才开始大量使用铝材料。这也反映出Cu、Fe、Al三种金属的活动性不同,其由强到弱的顺序是
(2)我国西汉就有“曾青得铁则化为铜”之说,用化学方程式表示其原理
(3)铁生锈主要与空气中的
(4)如图实验说明NaC1在铁生锈中的作用是

铁生锈的主要过程为:
(5)写出
(6)铁锈中一定含Fe2O3.nH2O,可能含FeCO3(FeCO3和稀HCl的反应与CaCO3相似),在某铁锈样品中加稀HCl,
(二)铁的化合物制备
用废铁屑制备铁红(主要成分为Fe2O3)的部分流程如下图所示:

(7)清洗时利用洗涤剂的
(8)流程中加入的铁粉除和H2SO4反应外,还和Fe2(SO4)3发生化合反应,此化合反应的化学方程式为
(9)加过量NH4HCO3反应时温度不宜过高的原因为
(10)在空气中灼烧FeCO3的反应为
(三)CH4还原Fe2O3的探究
取48.0gFe2O3粉末,用下图装置进行实验,并对反应及产物等作探究。

资料:①浓硫酸有吸水性,碱石灰可吸收H2O和CO2.②
(11)装配好实验装置后,先要
(12)加热前后及过程中均通入CH4,停止加热后继续通CH4的目的是防止倒吸和
(13)A中有如下反应:
a、y=2x b、装置B、C增加的质量比为9:22
(14)控温加热一段时间后,继续通CH4至冷却,A中剩余的35.2g固体为Fe和FeO的混合物。在剩余固体中加一定量硫酸溶液,反应刚好完全。
①剩余固体中FeO质量为
②剩余固体和稀硫酸完全反应形成FeSO4的质量为
22-23九年级上·江苏镇江·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网