综合应用题 困难0.15 引用1 组卷343
碳的氧化物在生活、生产中用途广泛。
Ⅰ.探究CO的还原性。
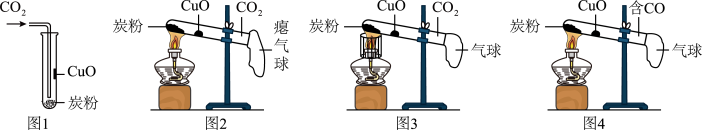
实验1:将CuO加水制成糊状,刷在试管内壁,在试管底部加入炭粉,再向试管里
通入CO2(见图1),集满后立即用气球密封。
实验2:用酒精灯先加热CuO部位(见图2),无明显现象。
实验3:再用加网罩的酒精灯加热炭粉(见图3);一段时间后,利用CO2传感器测得试管内CO2含量变小。
实验4:加热CuO(见图4),黑色固体变成紫红色。
(1)实验2得到的结论是_______ 。
(2)实验3的目的是_______ ,酒精灯加网罩的作用是_______ 。
(3)写出实验4中发生反应的化学方程式:_______ 。
Ⅱ.CO2捕捉和利用。
(4)CO2的捕捉:利用氨水(NH3·H2O)捕捉CO2,得到高纯度CO2的流程如图。
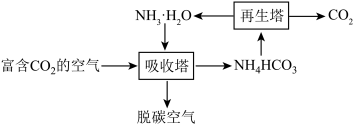
①吸收塔中NH3•H2O常采用雾状喷淋技术,其目的是_______ 。
②再生塔中发生反应的化学方程式为_______ 。
(5)二氧化碳的资源化利用。
中国科学家已实现由CO2到淀粉的全人工合成,主要过程如下:

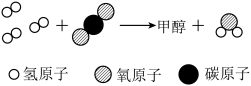
①阶段I反应的微观过程如图。甲醇中C、H、O三种原子的个数比为_______ 。
②阶段Ⅱ的物质转化如图所示。反应a中四种物质的化学计量数均为1。
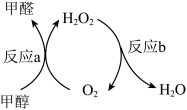
a.推测分子中氢原子数目:甲醇_______ 甲醛(填“>”、“<”或“=”)。
b.为使甲醇持续转化为甲醛,反应b需补充H2O2,理论上需补充的H2O2与反应a中生成的H2O2的分子个数比: ≥
≥_______ 。
Ⅰ.探究CO的还原性。
实验1:将CuO加水制成糊状,刷在试管内壁,在试管底部加入炭粉,再向试管里
通入CO2(见图1),集满后立即用气球密封。
实验2:用酒精灯先加热CuO部位(见图2),无明显现象。
实验3:再用加网罩的酒精灯加热炭粉(见图3);一段时间后,利用CO2传感器测得试管内CO2含量变小。
实验4:加热CuO(见图4),黑色固体变成紫红色。

(1)实验2得到的结论是
(2)实验3的目的是
(3)写出实验4中发生反应的化学方程式:
Ⅱ.CO2捕捉和利用。
(4)CO2的捕捉:利用氨水(NH3·H2O)捕捉CO2,得到高纯度CO2的流程如图。

①吸收塔中NH3•H2O常采用雾状喷淋技术,其目的是
②再生塔中发生反应的化学方程式为
(5)二氧化碳的资源化利用。
中国科学家已实现由CO2到淀粉的全人工合成,主要过程如下:

①阶段I反应的微观过程如图。甲醇中C、H、O三种原子的个数比为

②阶段Ⅱ的物质转化如图所示。反应a中四种物质的化学计量数均为1。

a.推测分子中氢原子数目:甲醇
b.为使甲醇持续转化为甲醛,反应b需补充H2O2,理论上需补充的H2O2与反应a中生成的H2O2的分子个数比:
22-23九年级上·江苏无锡·阶段练习
类题推荐
金属钴(Co)是一种“氢前金属”,金属活动性介于Zn和Cu之间,Co元素常见的化合价为+2和+3。金属Co与酸反应后显+2,Co元素常见的化合物相关性质如下:
(1)根据金属化学性质的一般规律。下列预测合理的是___________。
(2)碳酸钴(CoCO3)是一种难溶于水的粉红色固体,结合所学知识预测,CoCO3能与____ (填物质类别)反应,验证预测的实验操作和预期现象是:取CoCO3固体于试管中_______ 。
(3)依据各类物质间的反应规律,根据以下限选试剂,设计一种制备CoCO3的方案(见以下表格)该方案包含两个实验步骤,请完成表格。.
限选试剂:钴粉、氢氧化钴固体、碳酸钠溶液、氢氧化钠溶液、稀硫酸、锌片、铜片
(4)从含钴的矿石中提取钴的工艺过程一般是会先用足量的酸进行酸浸,酸浸时,钴的氧化物发生如下反应:
反应I:CoO + H2SO4 =CoSO4 +H2O
反应II:2Co2O3 + 4H2SO4 =4CoSO4 +4H2O +O2↑
反应III:Co2O3 +Na2SO3+2H2SO4 =2CoSO4 +2H2O +Na2SO4
①反应后溶液中含钴元素的微粒是:_____ (填化学符号)。
②已知,反应前含有CoO和Co2O3 的矿石(矿石中钴元素的质量分数为59%)的质量为b g 则理论上可以生成CoSO4的质量为______ (用含b的式子表示)。
| 物质 | CoO | Co(OH)2 | CoCl2 | CoSO4 | Co(NO3)2 | CoCO3 |
| 在水中的溶解性 | 难溶于水的灰绿色固体 | 难溶于水的粉红色固体 | 易溶于水形成粉红色溶液 | 易溶于水形成粉红色溶液 | 易溶于水形成粉红色溶液 | 难溶于水的粉红色固体 |
| A.钴能够与氢氧化钠溶液反应 |
| B.H2或者CO能够将钴的氧化物转化为金属钴 |
| C.钴能够与盐酸或者稀硫酸反应 |
| D.硫酸钴溶液中的硫酸锌可以加入钴粉除去 |
(3)依据各类物质间的反应规律,根据以下限选试剂,设计一种制备CoCO3的方案(见以下表格)该方案包含两个实验步骤,请完成表格。.
限选试剂:钴粉、氢氧化钴固体、碳酸钠溶液、氢氧化钠溶液、稀硫酸、锌片、铜片
| 实验步骤 | 预期反应的化学方程式 | 预期反应的实验现象 |
反应I:CoO + H2SO4 =CoSO4 +H2O
反应II:2Co2O3 + 4H2SO4 =4CoSO4 +4H2O +O2↑
反应III:Co2O3 +Na2SO3+2H2SO4 =2CoSO4 +2H2O +Na2SO4
①反应后溶液中含钴元素的微粒是:
②已知,反应前含有CoO和Co2O3 的矿石(矿石中钴元素的质量分数为59%)的质量为b g 则理论上可以生成CoSO4的质量为
2021 年某市九年级化学实验操作考查“探究金属活动性”,同学们依据所提供的药品设计三种最简实验方案方案探究“锌、铁、铜的金属活动性”三种实验方案的实施过程如下图所示。请根据实验考查过程完成以下问题:
(一)根据实验方案可知:
(1). 实验中砂纸的作用是______ ;
(2). 三个实验方案理论上均可行,但是实际实验中方案______ 不合适,原因是______ ;
(3). 方案三实验,某试管内实验前后的溶液中主要离子的变化示意图如图所示:
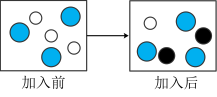
①图中“ ”所代表的微粒符号为
”所代表的微粒符号为______ ;
②溶液质量大小关系是:加入前______ 加入后(填“>”、“<”或“=”)。
(二)同学将三种方案实验后的废液均倒入同一烧杯中,废液为蓝绿色。为避免污染设计以下实验流程回收得到相关氧化物。
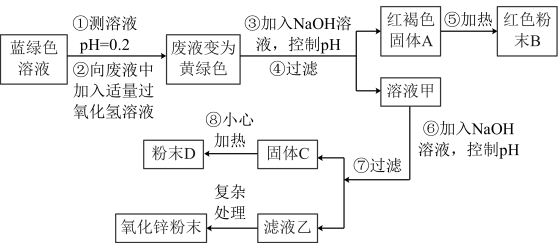
已知:氢氧化铜、氢氧化铁等不溶性碱在加热时易分解,生成两种氧化物;
(4). “蓝绿色废液”中含有的阳离子有______ 种;
(5). 步骤②发生的化学反应方程式______ ; 步骤③“加入氢氧化钠溶液”并控制 pH 的范围是______ ;
(6). 红色粉末 B 的化学式为______ ,固体 C 的颜色为______ ;
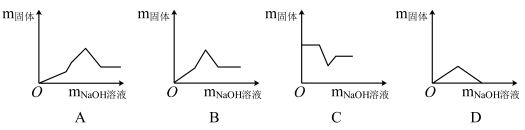
(7). 步骤⑥加入 NaOH 溶液同时必须控制 pH>13.6,其实验目的是______ ,以下符合该实验时溶液中的固体质量变化为______ (填字母);
(8). 步骤⑧“小心加热”必须控制温度在 650℃以下,否则粉末 D 将发生分解反应生成氧气和另一金属氧化物。所以将 9.8g 固体 C 加热,所得固体粉末质量范围是:______ ≤m<9.8g。
 |  |  |
| 方案一 | 方案二 | 方案三 |
(1). 实验中砂纸的作用是
(2). 三个实验方案理论上均可行,但是实际实验中方案
(3). 方案三实验,某试管内实验前后的溶液中主要离子的变化示意图如图所示:

①图中“
 ”所代表的微粒符号为
”所代表的微粒符号为②溶液质量大小关系是:加入前
(二)同学将三种方案实验后的废液均倒入同一烧杯中,废液为蓝绿色。为避免污染设计以下实验流程回收得到相关氧化物。

已知:氢氧化铜、氢氧化铁等不溶性碱在加热时易分解,生成两种氧化物;
| 氢氧化物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 4.8 | 6.2 |
| 完全沉淀的pH | 3.2 | 6.7 | 9.1 |
| 加碱液开始溶解的pH | >10.5 |
(4). “蓝绿色废液”中含有的阳离子有
(5). 步骤②发生的化学反应方程式
(6). 红色粉末 B 的化学式为
(7). 步骤⑥加入 NaOH 溶液同时必须控制 pH>13.6,其实验目的是

(8). 步骤⑧“小心加热”必须控制温度在 650℃以下,否则粉末 D 将发生分解反应生成氧气和另一金属氧化物。所以将 9.8g 固体 C 加热,所得固体粉末质量范围是:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网