科学探究题 较难0.4 引用2 组卷193
某班同学分三个小组对酸、碱、盐的化学性质进行了探究:
(1)第一组为了证明稀盐酸与氢氧化钠溶液发生了反应,涉及了如图一所示实验,传感器测定的PH和温度随溶液质量的变化情况为图二、图三。
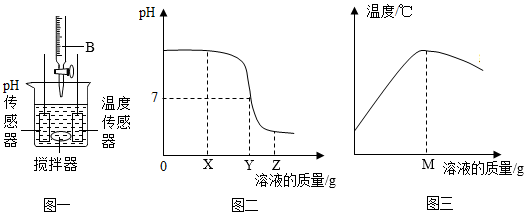
由图二可以判断实验中加入的B溶液是________ ,写出反应的化学方程式______ ,图三中的M与图二中的X、Y、Z中的________ 数值相等。
(2)第二组作了如图所示实验
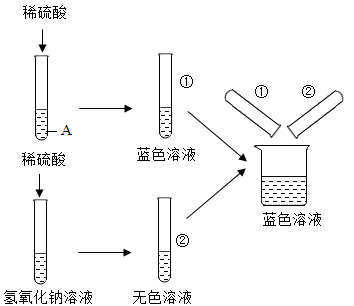
①写出A与稀盐酸反应的化学方程式___________
②【提出问题】
②号试管中无色溶液的溶质是什么?
【作出猜想】猜想一:氯化钠
猜想二:____________
猜想三:氯化钠、氢氧化钠
【反思】甲同学认为猜想三不成立,因为①②试管中溶液混合后烧杯中没有蓝色沉淀生成,乙同学则认为猜想三可以成立,理由是__________ 。
(3)第三组将一定量的澄清石灰水加入10g7.3%的稀盐酸中,未观察到明显现象,再向混合后的溶液中滴加溶质质量分数为5%的碳酸钠溶液,信号杯中溶液的质量与碳酸钠溶液的质量关系如图所示:
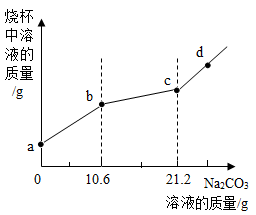
①图示信息________ (填“能”或“不能”)作为稀盐酸和澄清石灰水发生反应的证据,理由是_________ 。
②写出bc段发生反应的化学方程式__________ 。
(1)第一组为了证明稀盐酸与氢氧化钠溶液发生了反应,涉及了如图一所示实验,传感器测定的PH和温度随溶液质量的变化情况为图二、图三。

由图二可以判断实验中加入的B溶液是
(2)第二组作了如图所示实验

①写出A与稀盐酸反应的化学方程式
②【提出问题】
②号试管中无色溶液的溶质是什么?
【作出猜想】猜想一:氯化钠
猜想二:
猜想三:氯化钠、氢氧化钠
【反思】甲同学认为猜想三不成立,因为①②试管中溶液混合后烧杯中没有蓝色沉淀生成,乙同学则认为猜想三可以成立,理由是
(3)第三组将一定量的澄清石灰水加入10g7.3%的稀盐酸中,未观察到明显现象,再向混合后的溶液中滴加溶质质量分数为5%的碳酸钠溶液,信号杯中溶液的质量与碳酸钠溶液的质量关系如图所示:

①图示信息
②写出bc段发生反应的化学方程式
2022·贵州黔南·模拟预测
类题推荐
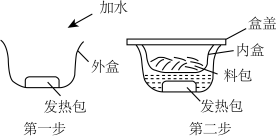
近年比较流行的“自热米饭”给人们生活带来方便。“自热米饭”主要由出料包和发热包组成,食用方法如图所示。
(1)从均衡膳食的角度考虑,搭配 (填标号)一起食用营养会更均衡。
(2)该自热米饭配料表中共涉及到_____ 种营养素。
Ⅱ.兴趣小组对网购的某食品专用发热包(部分标签如图所示)进行了探究。
(3)甲同学认为热量来自于氧化钙和水的反应,其反应方程式为_______ 。
(4)使用方法中要求加常温水而不是热水的目的是_______ 。
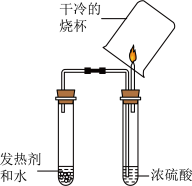
探究一:注意事项中为什么要求“远离明火,严禁在密闭场所中使用”?
【猜想假设】生成的气体是可燃性气体。
【查阅资料】2A1+2NaOH+2H2O=2NaA1O2+3H2↑,反应放热。
【进行实验】气体经检验纯度后,按如图装置进行实验,观察到预期现象。_______ 。
探究二:如何简单自制发热包?
【实验测定】
①称取50g发热剂放入烧杯中。加入足量的水,充分搅拌,静置。
②取上层清液, ,证明碳酸钠已完全反应。
③过滤,取滤渣洗涤干燥,称得固体7.5g。
(6)实验步骤②中划线处的合理方案是_______ 。(实验方案包括操作、现象。可供选用的试剂有:盐酸、氯化钙溶液、酚酞)
(7)若需将碳酸钠充分利用,则一包(50克)的发热包中,含有的氧化钙质量至少为_______ 。(写出解题过程)
【粗略制作】
(8)根据计算结果,将一定质量的碳酸钠粉末、氧化钙粉末(稍过量)、铝粉混合均匀,倒入无纺布袋中封口,将自制发热包加水后,反应中的温度和pH变化如图所示。下列说法正确的是 。
| 营养物质 | 蛋白质 | 油脂 | 糖类 | 钠 | 钙 |
| 每份含量 | 29.6g | 23.5g | 104.7g | 814mg | 130mg |
(1)从均衡膳食的角度考虑,搭配 (填标号)一起食用营养会更均衡。
| A.鸡蛋 | B.牛奶 | C.苹果 |
(2)该自热米饭配料表中共涉及到
Ⅱ.兴趣小组对网购的某食品专用发热包(部分标签如图所示)进行了探究。

(3)甲同学认为热量来自于氧化钙和水的反应,其反应方程式为
(4)使用方法中要求加常温水而不是热水的目的是
探究一:注意事项中为什么要求“远离明火,严禁在密闭场所中使用”?
【猜想假设】生成的气体是可燃性气体。
【查阅资料】2A1+2NaOH+2H2O=2NaA1O2+3H2↑,反应放热。
【进行实验】气体经检验纯度后,按如图装置进行实验,观察到预期现象。
探究二:如何简单自制发热包?
【实验测定】
①称取50g发热剂放入烧杯中。加入足量的水,充分搅拌,静置。
②取上层清液, ,证明碳酸钠已完全反应。
③过滤,取滤渣洗涤干燥,称得固体7.5g。
(6)实验步骤②中划线处的合理方案是
(7)若需将碳酸钠充分利用,则一包(50克)的发热包中,含有的氧化钙质量至少为
【粗略制作】
(8)根据计算结果,将一定质量的碳酸钠粉末、氧化钙粉末(稍过量)、铝粉混合均匀,倒入无纺布袋中封口,将自制发热包加水后,反应中的温度和pH变化如图所示。下列说法正确的是 。
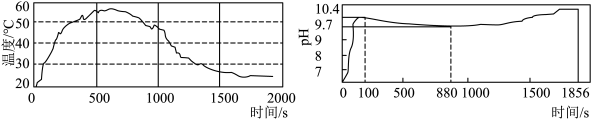
| A.反应后溶液碱性较强,有腐蚀性,所以废液不能随意丢弃 |
| B.0~110s内,pH上升的原因仅是氧化钙和水生成氢氧化钙 |
| C.110~880s内,pH变化的原因是氢氧化钠被铝粉逐渐消耗 |
| D.880s~1856s内,随着氢氧化钙溶解度逐渐变大,pH上升 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网