实验题 0.4 引用1 组卷141
某同学设计如图实验装置进行氢气还原氧化铜实验(U形管中盛有足量的碱石灰,碱石灰是氧化钙和氢氧化钠的混合物)。实验中观察到黑色粉末全部变为红色,把反应后的红色粉末倒入到盛有稀硫酸的烧杯中,发现溶液居然变为蓝色,这引起了他的好奇。为探究反应后红色粉末的成分,他查阅资料得知:氢气还原CuO也可生成红色固体Cu2O;Cu2O能与稀硫酸反应,反应的化学方程式为:
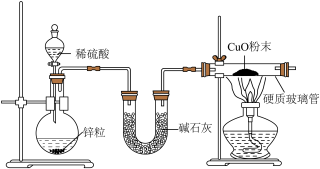
(1)取用氧化铜粉末,需要用到的仪器是______(填序号)。
(2)用锌粒和稀硫酸制取氢气反应的化学反应方程式为______ 。
(3)Cu2O中铜元素的化合价为______ 。
(4)取2.88g红色粉末甲于试管中,加入足量的稀硫酸,充分反应后,过滤洗涤干燥,得到红色固体乙mg。若“红色粉末甲”是Cu2O和Cu的混合物,则m的取值范围是______ 。
(5)关于以上实验,下列说法正确的是______(填序号)。

(1)取用氧化铜粉末,需要用到的仪器是______(填序号)。
| A.镊子 | B.药匙 | C.胶头滴管 |
(3)Cu2O中铜元素的化合价为
(4)取2.88g红色粉末甲于试管中,加入足量的稀硫酸,充分反应后,过滤洗涤干燥,得到红色固体乙mg。若“红色粉末甲”是Cu2O和Cu的混合物,则m的取值范围是
(5)关于以上实验,下列说法正确的是______(填序号)。
| A.实验过程中应先点燃酒精灯,然后向烧瓶内加入稀硫酸 |
| B.实验过程中U形管内发生了化合反应和中和反应 |
| C.熄灭酒精灯后,需继续通入氢气直到装置冷却防止硬质玻璃管中的剩余固体被氧化 |
| D.若烧瓶内产生氢气的质量为a,硬质玻璃管内固体质量减少了b,则a:b= 1:8 |
21-22九年级下·湖北武汉·阶段练习


