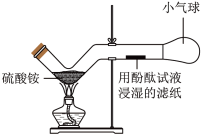
科学探究题 适中0.65 引用1 组卷70
饮食不规律,经常食用刺激性食物会引起慢性胃炎,“胃必治”是治疗慢性胃炎的一种药物。
【查阅资料】①该药物中一定含有NaHCO3,可能含MgCO3和Al(OH)3中的一种或均不含。
②其他成分不影响有效成分的检测。
③MgCO3为白色微溶物。
④氢氧化铝可溶于过量的NaOH中。
【提出问题】该药物的有效成分是什么?
NaHCO3可用于治疗胃病的原因是______ (用化学方程式回答)。
【实验方案】
【讨论交流】
(1)小华认为上述实验方案无法证明该胃药中是否含有氢氧化铝原因是______ 。
(2)小明提出先将不溶物用稀硝酸溶解后再加入过量的NaOH溶液,若观察到______ ,可证明该不溶物中存在氢氧化铝和碳酸镁。
【实验结论】经实验确定该胃药中有效成分为NaHCO3和MgCO3。
【延伸拓展】
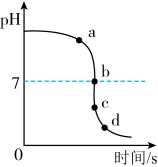
如图是,组胃病患者在空腹状态下24小时胃液pH的变化曲线。科学家发现人体胃液的pH影响人体对药物的吸收,胃液pH低时,胃液分泌多,胃对弱酸性类药物的吸收相对多;胃液pH高时,胃液分泌少,有利于弱碱性类药物的吸收。
(1)分析上图你认为该患者若需服用胃必治,最佳服用时间是______ 。
(2)在用X线检查胃病时,经常要食用“钡餐”,该物质不能与胃酸反应否则会引起重金属中毒,你认为它化学式应该为______ 。
【查阅资料】①该药物中一定含有NaHCO3,可能含MgCO3和Al(OH)3中的一种或均不含。
②其他成分不影响有效成分的检测。
③MgCO3为白色微溶物。
④氢氧化铝可溶于过量的NaOH中。
【提出问题】该药物的有效成分是什么?
NaHCO3可用于治疗胃病的原因是
【实验方案】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量胃药于试管中,加水 | 该胃药中一定含有碳酸镁或者氢氧化铝中的一种 | |
| ②取①中不溶性固体滴加硝酸溶液 | 有气泡产生 | 该胃药中一定含有 |
(1)小华认为上述实验方案无法证明该胃药中是否含有氢氧化铝原因是
(2)小明提出先将不溶物用稀硝酸溶解后再加入过量的NaOH溶液,若观察到
【实验结论】经实验确定该胃药中有效成分为NaHCO3和MgCO3。
【延伸拓展】
如图是,组胃病患者在空腹状态下24小时胃液pH的变化曲线。科学家发现人体胃液的pH影响人体对药物的吸收,胃液pH低时,胃液分泌多,胃对弱酸性类药物的吸收相对多;胃液pH高时,胃液分泌少,有利于弱碱性类药物的吸收。

(1)分析上图你认为该患者若需服用胃必治,最佳服用时间是
(2)在用X线检查胃病时,经常要食用“钡餐”,该物质不能与胃酸反应否则会引起重金属中毒,你认为它化学式应该为
2022·陕西宝鸡·模拟预测
类题推荐
某学习小组调查得知硫酸型酸雨会导致土壤酸化影响农作物生长;汽车使用的铅酸蓄电池的电解液中含有硫酸,电解液的密度在1.24g/mL~1.30 g/mL为合格。
(1)农业上常用___________ 来中和酸性土壤。
(2)为了检测某铅酸蓄电池的电解液是否合格,该小组同学量取100mL电解液后,还应获取的实验数据是___________ 。
(3)铅酸蓄电池废弃的电解液需作无害化处理,同学们提出以下两个方案:
方案一:用BaCl2溶液来处理,判断该方案的可行性并说明理由_____ 。
方案二:用KOH溶液来处理。请回答下列问题:
①混合后溶液中发生反应的化学方程式是___________ 。
②混合后溶液中溶质的组成
假设1:只有K2SO4
假设2: K2SO4 和KOH
假设3:___________ 。
③设计实验检验混合后溶液中溶质的成分。
④根据实验检测出的溶质成分,小组同学一致认为向溶液 中加入适量以下试剂___________ (填字母编号),可提供给学校生物园作为钾氮复合肥直接使用。
a.稀HNO3 b.Ba(NO3)2溶液 c.Mg(NO3)2溶液
(1)农业上常用
(2)为了检测某铅酸蓄电池的电解液是否合格,该小组同学量取100mL电解液后,还应获取的实验数据是
(3)铅酸蓄电池废弃的电解液需作无害化处理,同学们提出以下两个方案:
方案一:用BaCl2溶液来处理,判断该方案的可行性并说明理由
方案二:用KOH溶液来处理。请回答下列问题:
①混合后溶液中发生反应的化学方程式是
②混合后溶液中溶质的组成
假设1:只有K2SO4
假设2: K2SO4 和KOH
假设3:
③设计实验检验混合后溶液中溶质的成分。
| 实验操作 | 现象与结论 |
| 取少量混合后的溶液于试管中, |
a.稀HNO3 b.Ba(NO3)2溶液 c.Mg(NO3)2溶液
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网