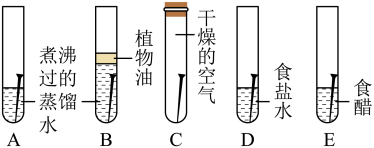
综合应用题 较难0.4 引用2 组卷241
金属材料发展突飞猛进,其对人类生产、生活和社会发展有着极其重要作用。人类制得并利用金属历史悠久,研究金属发展过程为:存在形式→冶炼方法→性质应用。
【存在形式】
(1)金属化合物在自然界中以矿物的形式存在。现有①铝土矿②磁铁矿③黄铜矿三种矿石,其中可用来冶炼金属铜的是__________ 。
【冶炼方法】
(2)电解熔融氯化镁可得到镁和氯气的化学方程式为____________ 。
(3)《淮南万毕术》中有“曾青得铁则化为铜”的记载,其化学方程式为_________ ,基本反应类型是__________ 。
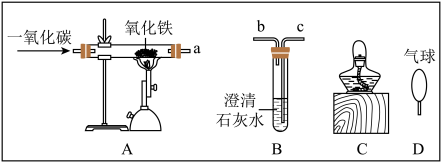
(4)下图为工业高炉炼铁剂而图和实验室模拟工业炼铁的部分仪器与装置。
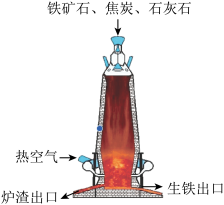
①工业炼铁时所需原料有____________ 。
②模拟炼铁时,A装置a口需要与B装置的(填字母)___________ 口相连接,模拟炼铁的化学反应方程式为___________ 。
③实验产生的尾气不能直接排放,你选择的处理装置是_________ 。
④若用含氧化铁240t的赤铁矿石为原料进行炼铁,理论上可得到含杂质4%的生铁质量为__________ 。
【性质用途】
(5)用铁制锅铲需要加上木柄或塑料柄,这是因为铁具有___________ 。
(6)在常温下,铝能“自我保护”的原因是_____________ 。
【存在形式】
(1)金属化合物在自然界中以矿物的形式存在。现有①铝土矿②磁铁矿③黄铜矿三种矿石,其中可用来冶炼金属铜的是
【冶炼方法】
(2)电解熔融氯化镁可得到镁和氯气的化学方程式为
(3)《淮南万毕术》中有“曾青得铁则化为铜”的记载,其化学方程式为
(4)下图为工业高炉炼铁剂而图和实验室模拟工业炼铁的部分仪器与装置。


①工业炼铁时所需原料有
②模拟炼铁时,A装置a口需要与B装置的(填字母)
③实验产生的尾气不能直接排放,你选择的处理装置是
④若用含氧化铁240t的赤铁矿石为原料进行炼铁,理论上可得到含杂质4%的生铁质量为
【性质用途】
(5)用铁制锅铲需要加上木柄或塑料柄,这是因为铁具有
(6)在常温下,铝能“自我保护”的原因是
21-22九年级上·辽宁沈阳·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网