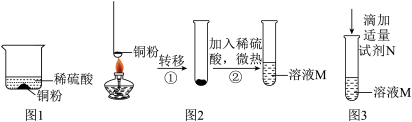
科学探究题 适中0.65 引用1 组卷125
某学习小组对铜丝在空气中灼烧后的产物进行探究。
实验1:甲同学将螺旋状铜丝灼烧至红热,冷却后观察到铜丝表面变为黑色,再伸入质量分数为25%的稀硫酸中,黑色固体消失,溶液出现蓝色,将铜丝取出洗净;重复上述实验2~3次,溶液蓝色逐渐加深。
【实验分析】灼烧铜丝生成黑色固体,该反应属于基本反应类型中的________ 反应,溶液变为蓝色的原因是黑色固体溶于稀硫酸变成硫酸铜溶液,写出生成硫酸铜的化学方程式_______ 。
实验2:乙同学将螺旋状铜丝灼烧至红热,迅速伸入质量分数为25%的稀硫酸中,观察到溶液中有红色固体产生,将铜丝取出洗净;重复上述实验2~3次,红色固体逐渐增多,沉淀后滤出红色固体,滤液呈浅蓝色。
【提出问题】红色固体是什么?
【查阅资料1】①Cu与O2在高于900℃时会反应生成红色的Cu2O。
②Cu2O能与H2SO4发生反应: 。
。
③加热条件下,Cu2O能与H2反应生成Cu和H2O。
【提出猜想】丙同学认为红色固体全部是Cu,不含Cu2O。
【实验验证1】学习小组取经过干燥的红色固体,采用如图装置验证猜想。
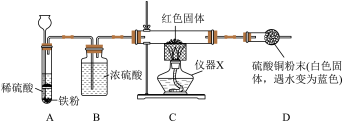
(1)仪器X的名称为_________ 。
(2)装置B中浓硫酸的作用是_________ 。
(3)实验时,应先将产生的氢气通入装置C中,待________ ,再开始加热。
(4)实验中观察到_______ (填实验现象),说明红色固体中含有Cu2O,丙同学猜想错误。
【提出问题2】实验2中有稀硫酸存在的情况下,为什么红色固体中仍含有Cu2O?
【查阅资料2】Cu2O与H2SO4反应的快慢与稀硫酸的浓度有关。稀硫酸的浓度越大,Cu2O与H2SO4反应越快。
【实验验证2】请设计实验验证“稀硫酸的浓度越大,Cu2O与H2SO4的反应越快”这一结论。简述实验过程(包括操作和现象):_______ 。
(实验中须使用的试剂:Cu2O、质量分数为5%和40%的稀硫酸)
【问题解决】因实验2中稀硫酸浓度变小,Cu2O与H2SO4反应变慢,Cu2O没有反应完全,故红色固体中仍含有Cu2O。
实验1:甲同学将螺旋状铜丝灼烧至红热,冷却后观察到铜丝表面变为黑色,再伸入质量分数为25%的稀硫酸中,黑色固体消失,溶液出现蓝色,将铜丝取出洗净;重复上述实验2~3次,溶液蓝色逐渐加深。
【实验分析】灼烧铜丝生成黑色固体,该反应属于基本反应类型中的
实验2:乙同学将螺旋状铜丝灼烧至红热,迅速伸入质量分数为25%的稀硫酸中,观察到溶液中有红色固体产生,将铜丝取出洗净;重复上述实验2~3次,红色固体逐渐增多,沉淀后滤出红色固体,滤液呈浅蓝色。
【提出问题】红色固体是什么?
【查阅资料1】①Cu与O2在高于900℃时会反应生成红色的Cu2O。
②Cu2O能与H2SO4发生反应:
③加热条件下,Cu2O能与H2反应生成Cu和H2O。
【提出猜想】丙同学认为红色固体全部是Cu,不含Cu2O。
【实验验证1】学习小组取经过干燥的红色固体,采用如图装置验证猜想。

(1)仪器X的名称为
(2)装置B中浓硫酸的作用是
(3)实验时,应先将产生的氢气通入装置C中,待
(4)实验中观察到
【提出问题2】实验2中有稀硫酸存在的情况下,为什么红色固体中仍含有Cu2O?
【查阅资料2】Cu2O与H2SO4反应的快慢与稀硫酸的浓度有关。稀硫酸的浓度越大,Cu2O与H2SO4反应越快。
【实验验证2】请设计实验验证“稀硫酸的浓度越大,Cu2O与H2SO4的反应越快”这一结论。简述实验过程(包括操作和现象):
(实验中须使用的试剂:Cu2O、质量分数为5%和40%的稀硫酸)
【问题解决】因实验2中稀硫酸浓度变小,Cu2O与H2SO4反应变慢,Cu2O没有反应完全,故红色固体中仍含有Cu2O。
21-22九年级上·江苏南通·阶段练习
类题推荐
金属铝和铜被广泛应用于生产生活中。
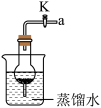
(1)探究铝和水的反应。
①生活中可用铝壶烧水,铝没与水反应,其原因是___________ (用化学方程式表示)。
②装置中的玻璃仪器有:烧杯、干燥管、导管,将打磨过的铝片放入的干燥管中,烧杯中装有热水,铝片表面有气泡出现、周围出现白色沉淀。你推测白色沉淀是___________ (填化学式)。
③如图装置内,在铝与热水反应的过程中,若关闭活塞K,反应会停止,其原因是___________ 。
(2)探究铜的性质。
某校化学兴趣小组将Cu块加到盛稀H2SO4的试管中,Cu块不溶解,不发生化学反应。再向此试管中加入KNO3溶液,发现Cu块逐渐溶解,有无色气体产生,该气体与空气接触后变成红棕色的气体,最后Cu块完全溶解,变成蓝色溶液。
[提出问题]
Cu块与什么物质发生了化学反应,产生的气体是H2吗?。
小军同学认为产生的气体一定不是H2,你认为他作出此判断的合理理由是___________ 。
[查阅资料]他们通过查阅资料知道:NO是种无色气体,与空气接触后生成红棕色的NO2。
[作出猜想]
猜想一:Cu块与KNO3溶液发生了化学反应;
猜想二:Cu块与K2SO4溶液发生了化学反应;
猜想三:Cu块与___________ 溶液发生了化学反应。
【设计实验】
【实验结论】猜想___________ 成立。
| 物质 | 铝和水 | 铜和水 |
| 能否发生反应 | 能反应 | 不能反应 |
(1)探究铝和水的反应。
①生活中可用铝壶烧水,铝没与水反应,其原因是
②装置中的玻璃仪器有:烧杯、干燥管、导管,将打磨过的铝片放入的干燥管中,烧杯中装有热水,铝片表面有气泡出现、周围出现白色沉淀。你推测白色沉淀是
③如图装置内,在铝与热水反应的过程中,若关闭活塞K,反应会停止,其原因是
(2)探究铜的性质。
某校化学兴趣小组将Cu块加到盛稀H2SO4的试管中,Cu块不溶解,不发生化学反应。再向此试管中加入KNO3溶液,发现Cu块逐渐溶解,有无色气体产生,该气体与空气接触后变成红棕色的气体,最后Cu块完全溶解,变成蓝色溶液。
[提出问题]
Cu块与什么物质发生了化学反应,产生的气体是H2吗?。
小军同学认为产生的气体一定不是H2,你认为他作出此判断的合理理由是
[查阅资料]他们通过查阅资料知道:NO是种无色气体,与空气接触后生成红棕色的NO2。
[作出猜想]
猜想一:Cu块与KNO3溶液发生了化学反应;
猜想二:Cu块与K2SO4溶液发生了化学反应;
猜想三:Cu块与
【设计实验】
| 实验步骤 | 实验现象 | 解释或结论 |
| ①将Cu块加入KNO3溶液中 | Cu块不溶解 | 说明猜想一是错误的 |
| ②将Cu块加到 | Cu块不溶解 | 说明猜想二是错误的 |
| ③将Cu块加到稀HNO3中 | Cu块溶解,有无色气体产生,气体与空气接触后变成红棕色,溶液变成蓝色 | 说明猜想三是正确的 |
为研究锌和铝的金属活动性,某研究小组进行了如下探究。
(1)小明设计的实验方案:向表面积相同的铝片和锌粒中分别加入盐酸。写出铝片与盐酸反应的化学方程式:___________ 。
(2)小芳铝片放入盐酸中,发现开始没有气泡产生,原因是___________ 。
小芳在(2)实验中,还观察到有“灰黑色沉淀”这一异常现象出现。
【提出问题】铝与盐酸反应出现的灰黑色沉淀的组成是什么?
【查阅文献】铝在颗粒较小时为灰黑色;AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。
【提出合理假设】
(3)假设a:该灰黑色沉淀可能含有___________ ;
假设b:该灰黑色沉淀可能含有AlCl3;
假设c:该灰黑色沉淀可能含有难溶于酸的物质。
【设计并完成实验】取灰黑色沉淀分别进行如下实验。
【得出结论】
(4)由实验①可判断假设c___________ (填“成立”或“不成立”),再结合②和③可得出该灰黑色沉淀的成分是___________ 。
(5)你认为①中小明的实验能否比较锌和铝的金属活动性强弱?原因可能是(写一条):___________ 。
(1)小明设计的实验方案:向表面积相同的铝片和锌粒中分别加入盐酸。写出铝片与盐酸反应的化学方程式:
(2)小芳铝片放入盐酸中,发现开始没有气泡产生,原因是
小芳在(2)实验中,还观察到有“灰黑色沉淀”这一异常现象出现。
【提出问题】铝与盐酸反应出现的灰黑色沉淀的组成是什么?
【查阅文献】铝在颗粒较小时为灰黑色;AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。
【提出合理假设】
(3)假设a:该灰黑色沉淀可能含有
假设b:该灰黑色沉淀可能含有AlCl3;
假设c:该灰黑色沉淀可能含有难溶于酸的物质。
【设计并完成实验】取灰黑色沉淀分别进行如下实验。
| 实验编号 | 实验操作 | 实验现象 |
| ① | 加入适量稀盐酸 | 有微量气泡,固体全部溶解,得到澄清溶液 |
| ② | 加入适量蒸馏水 | 固体部分溶解 |
| ③ | 加入适量无水乙醇 | 固体部分溶解 |
(4)由实验①可判断假设c
(5)你认为①中小明的实验能否比较锌和铝的金属活动性强弱?原因可能是(写一条):
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网