综合应用题 较难0.4 引用5 组卷425
古往今来,金属材料和制品在生产生活中应用广泛。
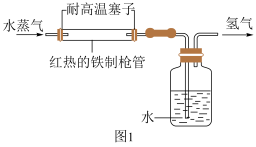
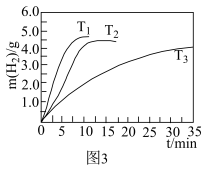
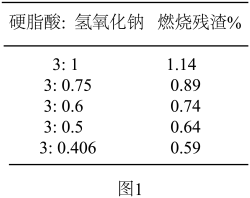
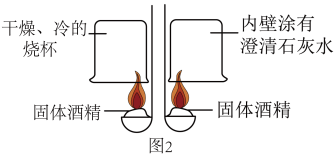
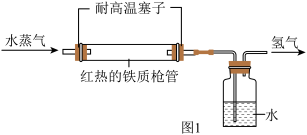
(1)三星堆遗址发据现场出土了华丽的鸟型金饰片,金能被加工成超薄金箔,是因为金具有良好的___________ ;同时出土的铜头像、青铜神树等表面有锈迹,铜生锈的主要原理是: ,X的化学式为
,X的化学式为_____________ 。
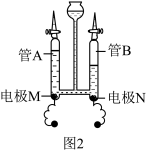
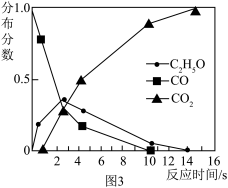
(2)向氧化铜和铁粉的混合物中加入一定量的稀硫酸,微热充分反应后冷却、过滤,得到滤渣和滤液。
①在滤液中加入一枚洁净的铁钉,发现铁钉表面无任何变化,则滤液中一定没有的阳离子是__________ 。(填离子符号)
②向滤渣中再滴入稀硫酸产生气泡,则滤渣中一定含有__________ 。(填名称)
(1)三星堆遗址发据现场出土了华丽的鸟型金饰片,金能被加工成超薄金箔,是因为金具有良好的
(2)向氧化铜和铁粉的混合物中加入一定量的稀硫酸,微热充分反应后冷却、过滤,得到滤渣和滤液。
①在滤液中加入一枚洁净的铁钉,发现铁钉表面无任何变化,则滤液中一定没有的阳离子是
②向滤渣中再滴入稀硫酸产生气泡,则滤渣中一定含有
2021·内蒙古鄂尔多斯·中考真题
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网