科学探究题 适中0.65 引用2 组卷75
化学兴趣小组为了探究金属与盐溶液发生置换反应的规律,进行了下列实验活动:
【提出问题】一种金属跟多种盐的混合溶液发生置换反应的规律是什么?
【实验探究】小组同学设计实验进行探究。
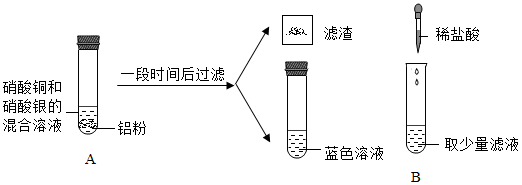
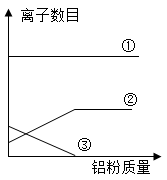
【实验分析】石建认真观察了滤渣和滤液,并取少量蓝色滤液于B试管中,滴加适量稀盐酸,没有观察到明显现象,确定滤液中一定没有的溶质是__ ,据此推断A中一定发生反应的化学方程式为__ ,因而确定了反应顺序。秦思另取少量蓝色滤液,重新加入过量的铝粉,充分反应,观察到的现象为__ 。加入铝粉过程中,滤液中Cu2+数目的变化趋势曲线应该是___ (如图,填序号)。
【实验结论】通过上述实验,同学们初步得出金属与盐溶液反应的规律。
【拓展延伸】通过查阅资料,小组同学了解到金属与盐在溶液中发生置换反应的实质是:金属原子与溶液中的金属离子之间发生了电子得失(转移),溶液中金属离子得电子能力越强,其对应金属的活动性越弱。据此可推断上述实验中涉及的三种金属离子得电子能力由强到弱依次是______ 。
【探究感悟】在此次探究活动中同学们再次认识到:证明物质发生化学反应,可根据明显的实验现象证明有其他物质生成或______ 。
【提出问题】一种金属跟多种盐的混合溶液发生置换反应的规律是什么?
【实验探究】小组同学设计实验进行探究。

【实验分析】石建认真观察了滤渣和滤液,并取少量蓝色滤液于B试管中,滴加适量稀盐酸,没有观察到明显现象,确定滤液中一定没有的溶质是

【实验结论】通过上述实验,同学们初步得出金属与盐溶液反应的规律。
【拓展延伸】通过查阅资料,小组同学了解到金属与盐在溶液中发生置换反应的实质是:金属原子与溶液中的金属离子之间发生了电子得失(转移),溶液中金属离子得电子能力越强,其对应金属的活动性越弱。据此可推断上述实验中涉及的三种金属离子得电子能力由强到弱依次是
【探究感悟】在此次探究活动中同学们再次认识到:证明物质发生化学反应,可根据明显的实验现象证明有其他物质生成或
2021·黑龙江哈尔滨·一模
类题推荐
已知锌与硫酸可以发生反应生成硫酸锌和氢气。某研究性学习小组在探究“影响锌与硫酸反应快慢的因素”时,发现一个意外现象:硫酸中混有硫酸铜溶液时,产生氢气的速率更快。
【查阅资料】①锌与硫酸反应的符号表达式 Zn + H2SO4 = ZnSO4 + H2
②锌与硫酸铜溶液反应的符号表达式 Zn + CuSO4 = ZnSO4 + Cu
③硫酸溶液中含有H+、硫酸根离子(用化学用语 表示_____________ );硫酸铜溶液中含有Cu2+、硫酸根离子;硫酸锌溶液中含有Zn2+、硫酸根离子。
【提出问题】是什么离子导致产生氢气的速率加快?
【猜想假设】甲同学:可能与铜离子有关;
乙同学:可能与硫酸根离子有关;
丙同学认为乙的猜想不科学,理由是_________ 。
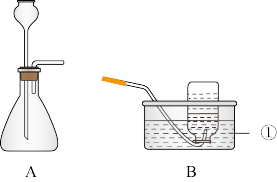
【实验验证】写出仪器①的名称__________ 。用A、B两组仪器进行实验:
步骤一:检查装置气密性。连接AB,用拇指堵住导管口,从长颈漏斗加水至一定高度,静置,观察到_______ ,即为气密性良好。
步骤二:量取2份质量分数为20%的稀硫酸各20mL,第一份加入质量分数为10%的硫酸铜溶液1mL,第二份加入质量分数为10%的硫酸锌溶液1mL。称取2份形状相同锌粒各1g,分别与以上溶液反应。反应装置如图A所示。用此装置实验时,长颈漏斗下端要插入液面以下,目的是__________ 。
步骤三:用B收集气体,分别记录收集一瓶气体(集气瓶规格均为125mL)所需的时间(如下表),什么时间开始收集气体?__________ 。(填“气泡连续均匀”或“刚有气泡”)
【得出结论】硫酸中混有硫酸铜溶液时,产生氢气的速率加快与__________ 有关。实验②中加入质量分数为10%的硫酸锌溶液1mL的作用是__________ 。
【反思质疑】丁同学认为:锌与混有硫酸铜的硫酸溶液反应时,产生氢气的速率较快可能与铜单质有关,他质疑的理由是__________ 。
【继续探究】请你设计一个实验方案验证丁同学的观点是否正确。
【查阅资料】①锌与硫酸反应的
②锌与硫酸铜溶液反应的
③硫酸溶液中含有H+、硫酸根离子(用

【提出问题】是什么离子导致产生氢气的速率加快?
【猜想假设】甲同学:可能与铜离子有关;
乙同学:可能与硫酸根离子有关;
丙同学认为乙的猜想不科学,理由是
【实验验证】写出仪器①的名称
步骤一:检查装置气密性。连接AB,用拇指堵住导管口,从长颈漏斗加水至一定高度,静置,观察到
步骤二:量取2份质量分数为20%的稀硫酸各20mL,第一份加入质量分数为10%的硫酸铜溶液1mL,第二份加入质量分数为10%的硫酸锌溶液1mL。称取2份形状相同锌粒各1g,分别与以上溶液反应。反应装置如图A所示。用此装置实验时,长颈漏斗下端要插入液面以下,目的是
步骤三:用B收集气体,分别记录收集一瓶气体(集气瓶规格均为125mL)所需的时间(如下表),什么时间开始收集气体?
| 编号 | 20%的稀硫酸各20mL | 锌粒 | 收集1瓶氢气所需的时间 |
| ① | 加入质量分数为10%的硫酸铜溶液1mL | 1g | 2分10秒 |
| ② | 加入质量分数为10%的硫酸锌溶液1mL | 1g | 3分01秒 |
【反思质疑】丁同学认为:锌与混有硫酸铜的硫酸溶液反应时,产生氢气的速率较快可能与铜单质有关,他质疑的理由是
【继续探究】请你设计一个实验方案验证丁同学的观点是否正确。
| 编号 | 实验步骤 | 实验现象比较 | 实验结论 |
| ① | 取1g锌粒于锥形瓶中, 加入20mL 20%的稀硫酸 | 产生氢气的速率较快与铜单质有关 | |
| ② |
兴趣小组的同学在探究金属的活动性顺序时,进行了如下拓展性学习与探究。
探究一:探究 的活动性顺序
的活动性顺序
【进行实验】同学们进行了题图所示的甲、乙实验。
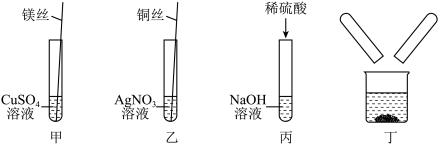
【小组交流】(1)实验中观察到,甲中镁丝表面附着一层________________ 色固体,乙中溶液颜色变为________________ 色。
(2)你认为通过甲、乙实验________________ (选填“能”或“不能”)得出三种金属的活动性顺序。
探究二:探究反应后混合溶液中溶质的成分
实验结束后,小组同学进行了题图所示的丁实验,将甲、丙试管中的废液同时倒入一个洁净的烧杯中,产生白色沉淀,上层为无色澄清溶液,为确认烧杯中溶液的溶质成分,同学们进行了拓展探究。
【知识回顾】丙中发生反应的化学方程式为________________________________ 。
【提出问题】丁中烧杯内溶液中溶质的成分是什么?
【作出猜想】猜想Ⅰ: 猜想Ⅱ:
猜想Ⅱ: 和
和
猜想Ⅲ: 猜想Ⅳ:
猜想Ⅳ: 和
和________________
【小组讨论】经过讨论,小组同学一致认为猜想________________ 不合理,理由是________________ 。
【实验验证】
探究一:探究
【进行实验】同学们进行了题图所示的甲、乙实验。

【小组交流】(1)实验中观察到,甲中镁丝表面附着一层
(2)你认为通过甲、乙实验
探究二:探究反应后混合溶液中溶质的成分
实验结束后,小组同学进行了题图所示的丁实验,将甲、丙试管中的废液同时倒入一个洁净的烧杯中,产生白色沉淀,上层为无色澄清溶液,为确认烧杯中溶液的溶质成分,同学们进行了拓展探究。
【知识回顾】丙中发生反应的化学方程式为
【提出问题】丁中烧杯内溶液中溶质的成分是什么?
【作出猜想】猜想Ⅰ:
猜想Ⅲ:
【小组讨论】经过讨论,小组同学一致认为猜想
【实验验证】
| 实验操作 | 实验现象 | 实验结论 |
| 取少量烧杯中的溶液于洁净试管中,向其中滴加 | 溶液变为红色 | 猜想Ⅲ正确 |
| 另取少量烧杯中的溶液于洁净试管中,向其中滴加 | 猜想Ⅲ正确 |
某化学兴趣小组的同学,为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动:【查阅资料】铁的活动性比铜强;金属R在生成物中通常显+2价。
【进行猜想】对三种金属的活动性顺序做出如下猜想:
猜想一:R>Fe>Cu;猜想二:_______ ;猜想三:Fe>Cu>R。
【收集证据】为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究。
写出金属R与硫酸铜反应的化学方程式_________ 。
【交流反思】三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。
【归纳总结】他们总结得出比较金属活动性强弱的常见方法有:
(1)_________
(2)__________
(3)__________
【进行猜想】对三种金属的活动性顺序做出如下猜想:
猜想一:R>Fe>Cu;猜想二:
【收集证据】为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究。
| 主要操作 | 主要现象 | 实验结论 | |
| 甲 | 将打磨好的R丝插入盛有硫酸铜溶液的试管中 | 猜想一正确 | |
| 乙 | 将粗细相同打磨好的R丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中 | ||
| 丙 | 将粗细相同打磨好的R丝、铁丝,分别在空气中点燃 | R丝在空气中剧烈燃烧,铁丝在空气中 |
写出金属R与硫酸铜反应的化学方程式
【交流反思】三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。
【归纳总结】他们总结得出比较金属活动性强弱的常见方法有:
(1)
(2)
(3)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


