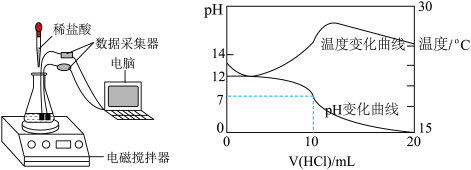
科学探究题 较难0.4 引用1 组卷110
兴趣小组设计实验探究氢氧化钠的性质,请你参与他们的探究。
【实验过程与分析】
(1)实验一的现象:______ 。
(2)实验二的现象:______ 。
(3)某同学认为实验三的结论不正确,他改进了该实验方案:先向氢氧化钠溶液中滴入几滴酚酞溶液并振荡,再滴入稀硫酸,观察到溶液由______ 色变为无色,由此可知氢氧化钠与稀硫酸确实发生了反应。
【反思与交流】
(4)由实验三联想到二氧化碳通入到氢氧化钠溶液中也没有明显现象,那么二氧化碳与氢氧化钠是否发生了化学反应呢?(本实验中忽略CO2溶于水)。
①甲同学设计了如图所示实验方案,当观察到______ 现象时,说明两者发生了化学反应。
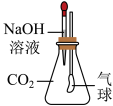
②乙同学重新设计实验方案:取NaOH溶液于试管中,通入少量CO2,然后向所得溶液中加入______ 溶液,当观察到______ 现象时,也能证明二氧化碳与氢氧化钠发生了化学反应。
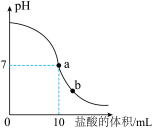
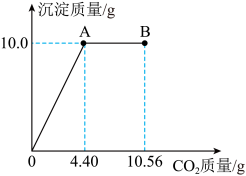
【拓展应用】将20.0 g NaOH、Ca(OH)2、NaCl组成的固体混合物溶于水配成溶液,向混合液中缓慢通入CO2气体(气体的溶解忽略不计),生成沉淀的质量与通入CO2气体的质量关系如图所示,请根据题意回答问题:
已知:


(5)经分析,A点溶液中所含溶质为______ (填化学式)。
(6)在B点时,溶液里碳元素均存在于NaHCO3中,若B点后继续通入足量的CO2气体,请将图像补充完整______ 。
(7)该混合物中NaCl的质量分数为多少?______ (写出计算过程,计算结果精确至0.1%)。
【实验过程与分析】
| 实验一 | 实验二 | 实验三 | |
| 实验操作 | 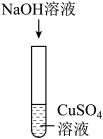 | 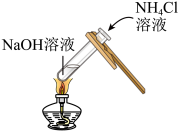 | 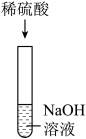 |
| 实验现象 | ______ | ______ | 无明显现象 |
| 实验结论 | 氢氧化钠能与硫酸铜发生反应 | 氢氧化钠能与氯化铵发生反应 | 氢氧化钠不能与硫酸发生反应 |
(2)实验二的现象:
(3)某同学认为实验三的结论不正确,他改进了该实验方案:先向氢氧化钠溶液中滴入几滴酚酞溶液并振荡,再滴入稀硫酸,观察到溶液由
【反思与交流】
(4)由实验三联想到二氧化碳通入到氢氧化钠溶液中也没有明显现象,那么二氧化碳与氢氧化钠是否发生了化学反应呢?(本实验中忽略CO2溶于水)。
①甲同学设计了如图所示实验方案,当观察到

②乙同学重新设计实验方案:取NaOH溶液于试管中,通入少量CO2,然后向所得溶液中加入
【拓展应用】将20.0 g NaOH、Ca(OH)2、NaCl组成的固体混合物溶于水配成溶液,向混合液中缓慢通入CO2气体(气体的溶解忽略不计),生成沉淀的质量与通入CO2气体的质量关系如图所示,请根据题意回答问题:

已知:
(5)经分析,A点溶液中所含溶质为
(6)在B点时,溶液里碳元素均存在于NaHCO3中,若B点后继续通入足量的CO2气体,请将图像补充完整
(7)该混合物中NaCl的质量分数为多少?
2021·江苏盐城·一模
类题推荐
某化学兴趣小组的同学在进行微专题复习时,围绕酸、碱中和反应这一问题展开了深度学习。请你参与其中,按要求回答问题和开展探究。
(1)下列选项的应用与中和反应的原理无关的是______ 。
A 使用浓硫酸干燥CO2气体
B 使用熟石灰改良酸性土壤
C 服用含有Al(OH)3的药物治疗胃酸过多症
D 利用氢氧化钠溶液洗涤石油产品中的残余硫酸
(2)某工厂化验室用10%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液80g,洗涤后的溶液呈中性。这一定量石油产品中含硫酸的质量是______ g。
(3)做酸碱中和反应实验时,向烧杯内的氢氧化钙溶液中加入一定量的稀盐酸后,发现忘记了滴加酸碱指示剂。因此,他们停止滴加稀盐酸,并对烧杯中溶液的溶质成分进行探究。
(提出问题)该烧杯中溶液的溶质是什么?
(猜想)猜想一:只含有CaCl2
猜想二:含有CaCl2、HCl和Ca(OH)2
猜想三:含有CaCl2和Ca(OH)2
猜想四:含有______ 。
同学们讨论后一致认为猜想二不合理,理由是______ 。
(查阅资料)氯化钙溶液呈中性。
(进行实验)同学们设计了如下不同的实验方案,证明猜想四是成立的。请帮他们填写有关实验步骤和实验现象。
(反思与拓展)要使烧杯内溶液的溶质只含有CaCl2,需要除去杂质,其中的一种方法是向烧杯中加入过量的某种物质,然后过滤,该除杂原理用化学方程式表示为______ 。
(1)下列选项的应用与中和反应的原理无关的是
A 使用浓硫酸干燥CO2气体
B 使用熟石灰改良酸性土壤
C 服用含有Al(OH)3的药物治疗胃酸过多症
D 利用氢氧化钠溶液洗涤石油产品中的残余硫酸
(2)某工厂化验室用10%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液80g,洗涤后的溶液呈中性。这一定量石油产品中含硫酸的质量是
(3)做酸碱中和反应实验时,向烧杯内的氢氧化钙溶液中加入一定量的稀盐酸后,发现忘记了滴加酸碱指示剂。因此,他们停止滴加稀盐酸,并对烧杯中溶液的溶质成分进行探究。
(提出问题)该烧杯中溶液的溶质是什么?
(猜想)猜想一:只含有CaCl2
猜想二:含有CaCl2、HCl和Ca(OH)2
猜想三:含有CaCl2和Ca(OH)2
猜想四:含有
同学们讨论后一致认为猜想二不合理,理由是
(查阅资料)氯化钙溶液呈中性。
(进行实验)同学们设计了如下不同的实验方案,证明猜想四是成立的。请帮他们填写有关实验步骤和实验现象。
| 方案 | 实验步骤 | 实验现象 |
| 一 | 取少量烧杯中的溶液于试管中,滴加几滴紫色石蕊溶液。 | |
| 二 | 将一颗生锈铁钉放入另一支试管中,取一定量烧杯中的溶液加入其中。 | |
| 三 | 另取少量烧杯中的溶液于第三支试管中,加入 | 产生气泡 |
(反思与拓展)要使烧杯内溶液的溶质只含有CaCl2,需要除去杂质,其中的一种方法是向烧杯中加入过量的某种物质,然后过滤,该除杂原理用化学方程式表示为
小茗同学在学习完酸、碱、盐的化学性质后,进行了如图所示的实验,请你来参与她的探究活动并回答下列问题。
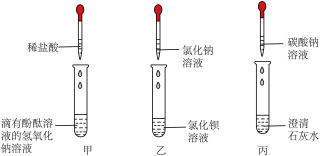
(1)甲试管中的化学反应方程式为____________ 。
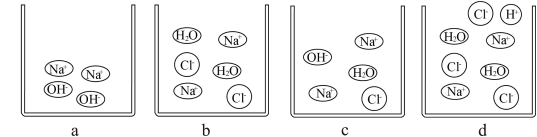
(2)实验结束后,小茗同学将三支试管内的物质全部倒入同一个干净的废液缸中,观察到白 色沉淀明显增多,废液缸中液体始终呈红色,为了得出废液缸中废液的溶质成分,小茗同学进行了以下的实验探究。
[提出问题]废液缸中废液的溶质成分有哪些(酚酞除外)?
[进行猜想]
猜想一:NaCl、NaOH、BaCl2; 猜想二:NaCl、NaOH; 猜想三:______________ 。
[设计实验]请你帮助小茗同学设计实验方案,证明猜想一成立。
【反思拓展】废液缸中的白色沉淀成分是_____________ (写出化学式)。

(1)甲试管中的化学反应方程式为
(2)实验结束后,小茗同学将三支试管内的物质全部倒入同一个干净的废液缸中,观察到白 色沉淀明显增多,废液缸中液体始终呈红色,为了得出废液缸中废液的溶质成分,小茗同学进行了以下的实验探究。
[提出问题]废液缸中废液的溶质成分有哪些(酚酞除外)?
[进行猜想]
猜想一:NaCl、NaOH、BaCl2; 猜想二:NaCl、NaOH; 猜想三:
[设计实验]请你帮助小茗同学设计实验方案,证明猜想一成立。
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量废液缸中的废液于试管中,加入 | / | 猜想二、猜想三不成立 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网