科学探究题 适中0.65 引用1 组卷83
小组同学收集了某种铝制易拉罐,剪成条状并打磨后进行如图所示实验,发现纯铝片表面有划痕。
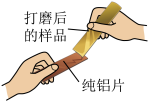
【发现问题】根据所学知识,合金的硬度比组成它的纯金属硬度更大,结合上述现象,可得出该易拉罐不是纯铝制作。那么易拉罐中除铝外,还含有什么金属呢?
【查阅资料】①铝制易拉罐中的主要成分是铝,可能还含有镁、铁。
②铝能与氢氧化钠溶液反应:2Al +2NaOH +2H2O=2NaAlO2 +3H2↑;镁和铁不能与氢氧化钠溶液反应。
【作出猜想】该易拉罐的金属组成除铝外,可能还含有镁、铁中的一种或两种。
【实验设计】小明取打磨后的铝制易拉罐样品按如下方案进行实验:
【实验结论】小明得出该易拉罐是由铝和铁组成。
【反思评价】其他同学分析后认为小明的实验方案不严谨,理由是______ ;大家认为应该补充下列实验:取步骤(1)中少量黑色粉末于试管中,加入某种金属化合物的溶液后,既能有明显现象,又能证明结论正确,你认为加入的这种金属化合物的溶液阳离子对应的金属,理论上可以是______ 。
【拓展应用】下图为国家颁布的“城市生活垃圾分类标志”,废弃易拉罐应放入标有______ (填序号)图标的垃圾桶内。


【发现问题】根据所学知识,合金的硬度比组成它的纯金属硬度更大,结合上述现象,可得出该易拉罐不是纯铝制作。那么易拉罐中除铝外,还含有什么金属呢?
【查阅资料】①铝制易拉罐中的主要成分是铝,可能还含有镁、铁。
②铝能与氢氧化钠溶液反应:2Al +2NaOH +2H2O=2NaAlO2 +3H2↑;镁和铁不能与氢氧化钠溶液反应。
【作出猜想】该易拉罐的金属组成除铝外,可能还含有镁、铁中的一种或两种。
【实验设计】小明取打磨后的铝制易拉罐样品按如下方案进行实验:
| 实验步骤 | 实验现象 | 解释与结论 |
| ①取一定量的样品于烧杯中,加入足量的 | 固体表面有大量气泡产生,过滤后得到黑色粉末。 | 样品中含铝 |
| ②取少量上述黑色粉末于试管中,加入足量的稀盐酸。 | 有气泡产生,溶液变成浅绿色。 | 样品中含铁 |
【反思评价】其他同学分析后认为小明的实验方案不严谨,理由是
【拓展应用】下图为国家颁布的“城市生活垃圾分类标志”,废弃易拉罐应放入标有

20-21九年级上·江苏苏州·阶段练习
类题推荐
蒸汽眼罩是我们日常生活中常见的缓解眼睛疲劳的产品,简单实用。某化学兴趣小组的同学对蒸汽眼罩开展了以下研究。
【查阅资料】I、蒸汽眼罩由无纺布眼罩和发热体构成。发热体内含有铁粉、活性炭、氯化钠、蛭石(保温作用,可以减缓热量散失)、高吸水树脂(良好保水性能,为眼罩提供水蒸气)等。
Ⅱ、铁粉、四氧化三铁均能被磁铁吸引。
任务一 验证蒸汽眼罩发热体内含有铁粉
(1)阿娜尔古丽同学用磁铁吸引了部分发热体内固体粉末,放入试管中,滴加硫酸铜溶液,观察到有红色固体析出,证明发热体内含有铁粉。该反应的化学方程式为______ 。
任务二 探究蒸汽眼罩的发热原理
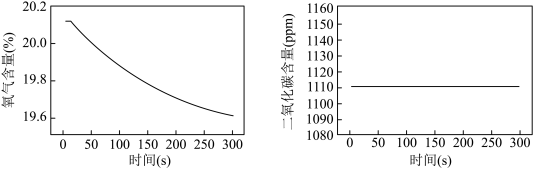
(2)根据“使用方法——打开蒸汽眼罩包装,接触空气即开始发热”,李明同学进行了以下实验:取20g发热体内固体粉末放入密闭容器中,通过数字传感器分别测得氧气和二氧化碳含量变化如下图。据图回答:发热体内的物质和空气中的______ 发生了反应,理由是______ 。
实验后,同学们观察到部分黑色固体变为红棕色,分析蒸汽眼罩的热量来源于铁粉生锈。有同学提出疑问,铁生锈是缓慢氧化放热不明显,但是蒸汽眼罩打开后会迅速升温,这是为什么呢?他们又设计了以下实验方案进行验证。
(3)实验2中应取用氯化钠的质量是______ g。实验4中温度迅速上升的原因是铁粉与______ 共同作用的结果。
【拓展延伸】
(4)工厂在蒸汽眼罩密封装袋时,应确保______ 。
【查阅资料】I、蒸汽眼罩由无纺布眼罩和发热体构成。发热体内含有铁粉、活性炭、氯化钠、蛭石(保温作用,可以减缓热量散失)、高吸水树脂(良好保水性能,为眼罩提供水蒸气)等。
Ⅱ、铁粉、四氧化三铁均能被磁铁吸引。
任务一 验证蒸汽眼罩发热体内含有铁粉
(1)阿娜尔古丽同学用磁铁吸引了部分发热体内固体粉末,放入试管中,滴加硫酸铜溶液,观察到有红色固体析出,证明发热体内含有铁粉。该反应的化学方程式为
任务二 探究蒸汽眼罩的发热原理
(2)根据“使用方法——打开蒸汽眼罩包装,接触空气即开始发热”,李明同学进行了以下实验:取20g发热体内固体粉末放入密闭容器中,通过数字传感器分别测得氧气和二氧化碳含量变化如下图。据图回答:发热体内的物质和空气中的

实验后,同学们观察到部分黑色固体变为红棕色,分析蒸汽眼罩的热量来源于铁粉生锈。有同学提出疑问,铁生锈是缓慢氧化放热不明显,但是蒸汽眼罩打开后会迅速升温,这是为什么呢?他们又设计了以下实验方案进行验证。
| 方案 | 药品 | 1分钟前后氧气含量变化 | 1分钟前后温度变化 |
| 实验1 | 4g铁粉、2mL水 | 20.1%→20.1% | 16℃→16℃ |
| 实验2 | 4g铁粉2mL水、______g氯化钠 | 20.1%-20.1% | 16℃→16℃ |
| 实验3 | 4g铁粉2mL水、2g活性炭 | 20.1%→20.1% | 16℃→16℃ |
| 实验4 | 4g铁粉2mL水,2g氯化钠2g活性炭 | 20.1%→15% | 16℃→55℃→26℃ |
(3)实验2中应取用氯化钠的质量是
【拓展延伸】
(4)工厂在蒸汽眼罩密封装袋时,应确保
同学们在探究金属的化学性质时,老师强调一般不用K、Ca、Na等活泼金属,否则会出现异常现象,并对钾和硫酸铜溶液的反应进行了演示实验。
【资料显示】
a.钾在常温下就能与水发生剧烈的反应,请补充完整发生反应的化学方程式:_____________ 。
b.碱式铜盐为蓝绿色沉淀。
C.钾在空气中其表面很快会被氧化。
【提出猜想】
猜想一:金属钾和硫酸铜溶液反应会有铜生成。
猜想二:金属钾和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钾块分别投入两种不同浓度的硫酸铜溶液中,有关实验现象如表所示:
实验及现象
【实验结论】
(1)上述实验中均未观察到_______ 色固体生成,由此判断猜想一错误。
(2)实验①中观察到的沉淀是蓝绿色的由此判断猜想二_______ (填“正确”或“错误”)。
【实验反思】
(1)实验中生成氢氧化铜沉淀的原理是_______________________ (用化学方程式表示)。
(2)由上述实验可知,导致钾和硫酸铜溶液反应产生的产物不同的因素有_______________ 。
【拓展提升】
为了用钾置换硫酸铜中的铜元素,老师设计了如下实验方案:
方案Ⅰ:把钾块和无水硫酸铜直接混合,在干燥的空气中加热。
方案Ⅱ:把钾块和无水硫酸铜直接混合,隔绝空气加热。
两个方案中你认为更合理的是方案_____ ,理由是_______________________________ 。
【资料显示】
a.钾在常温下就能与水发生剧烈的反应,请补充完整发生反应的化学方程式:
b.碱式铜盐为蓝绿色沉淀。
C.钾在空气中其表面很快会被氧化。
【提出猜想】
猜想一:金属钾和硫酸铜溶液反应会有铜生成。
猜想二:金属钾和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钾块分别投入两种不同浓度的硫酸铜溶液中,有关实验现象如表所示:
实验及现象
| 实验编号 | 钾块大小 | 硫酸铜溶液 | 实验现象 |
| ① | 绿豆大小 | 稀溶液10 mL | 产生蓝绿色沉淀 |
| ② | 绿豆大小 | 浓溶液10 mL | 产生蓝色絮状沉淀 |
| ③ | 黄豆大小 | 稀溶液10 mL | 产生蓝色絮状沉淀 |
| ④ | 黄豆大小 | 浓溶液10mL | 产体生蓝色絮状沉淀,并出现黑色固体 |
【实验结论】
(1)上述实验中均未观察到
(2)实验①中观察到的沉淀是蓝绿色的由此判断猜想二
【实验反思】
(1)实验中生成氢氧化铜沉淀的原理是
(2)由上述实验可知,导致钾和硫酸铜溶液反应产生的产物不同的因素有
【拓展提升】
为了用钾置换硫酸铜中的铜元素,老师设计了如下实验方案:
方案Ⅰ:把钾块和无水硫酸铜直接混合,在干燥的空气中加热。
方案Ⅱ:把钾块和无水硫酸铜直接混合,隔绝空气加热。
两个方案中你认为更合理的是方案
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网