综合应用题 较难0.4 引用1 组卷419
某化学兴趣小组在学习氨分子扩散实验时对这种有刺激性气味的气体产生了浓厚的兴趣,对其性质进行了探究性学习。
【查阅资料】(1)常温常压下,氨气(NH3)极易溶于水。
(2)氨气有还原性,在加热条件下可还原氧化铜。物质还原过程中,所含元素化合价会降低。
(3)Cu2O是红色固体,不溶于水,可与稀硫酸发生反应:Cu2O+H2SO4=CuSO4+Cu+H2O。
(4)白色无水硫酸铜粉末遇水变蓝色。
探究一:趣味实验
该小组同学应用氨气性质,设计了图1实验。用干燥的圆底烧瓶收集一瓶氨气,根据图1进行实验,挤压胶头滴管,使其中的水进入圆底烧瓶后,打开弹簧夹,观察到圆底烧瓶内形成红色喷泉。
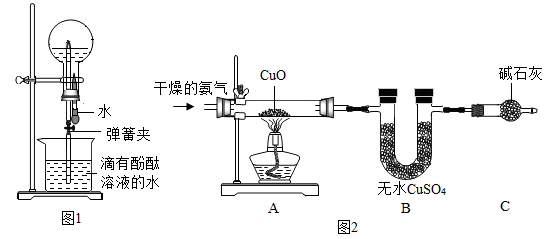
产生喷泉现象的原因是______ ,喷泉为红色的现象说明______ 。
探究二:氨气的还原性
小组同学利用图2装置进行NH3的还原性实验探究(夹持装置已略去)。先通入干燥的氨气,再加热酒精灯。实验中观察到______ 现象说明氨气具有还原性。该实验中C装置的作用是______ 。
【提出问题】充分反应后,硬质玻璃管内的固体物质G的成分是什么?
【猜想假设】猜想一:Cu
猜想二:Cu2O
猜想三:______
【实验验证】
(1)定性分析:根据实验现象分析,甲同学认为猜想二正确。乙同学认为甲同学的判断不准确,他的理由是______ 。
(2)定量分析:为进一步验证猜想,乙同学称取G物质7.2g,滴加稀硫酸至固体的量不再变化时,过滤、洗涤、干燥、称重固体质量为3.5g。
【实验结论】对比实验数据,证明猜想______ 正确。
【反思交流】该小组同学认为上述装置存在明显不足,你的改进措施是______ 。
【查阅资料】(1)常温常压下,氨气(NH3)极易溶于水。
(2)氨气有还原性,在加热条件下可还原氧化铜。物质还原过程中,所含元素化合价会降低。
(3)Cu2O是红色固体,不溶于水,可与稀硫酸发生反应:Cu2O+H2SO4=CuSO4+Cu+H2O。
(4)白色无水硫酸铜粉末遇水变蓝色。
探究一:趣味实验
该小组同学应用氨气性质,设计了图1实验。用干燥的圆底烧瓶收集一瓶氨气,根据图1进行实验,挤压胶头滴管,使其中的水进入圆底烧瓶后,打开弹簧夹,观察到圆底烧瓶内形成红色喷泉。

产生喷泉现象的原因是
探究二:氨气的还原性
小组同学利用图2装置进行NH3的还原性实验探究(夹持装置已略去)。先通入干燥的氨气,再加热酒精灯。实验中观察到
【提出问题】充分反应后,硬质玻璃管内的固体物质G的成分是什么?
【猜想假设】猜想一:Cu
猜想二:Cu2O
猜想三:
【实验验证】
| 实验步骤 | 实验现象 |
| 取少量G于试管中,滴加足量稀硫酸溶液 |
(1)定性分析:根据实验现象分析,甲同学认为猜想二正确。乙同学认为甲同学的判断不准确,他的理由是
(2)定量分析:为进一步验证猜想,乙同学称取G物质7.2g,滴加稀硫酸至固体的量不再变化时,过滤、洗涤、干燥、称重固体质量为3.5g。
【实验结论】对比实验数据,证明猜想
【反思交流】该小组同学认为上述装置存在明显不足,你的改进措施是
2020·甘肃兰州·中考真题
类题推荐
人类的生产生活离不开金属材料。
(一)请根据题目回答下列问题。
(1)铝、铁、铜是我们生产生活中使用比较广泛的金属.如图1所示用品中, 主要利用金属延展性的是______ (填字母序号)。

(2)铜也容易生锈,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3),是铜与空气中的氧气、水和_______ 共同作用的结果。
(3)合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质.一般来说合金的熔点低于任何一种组成金属的熔点.下表是一些金属的熔点数据。
①铅锡合金中某种金属的质量分数与合金的熔点有如图2所示的关系, 其中横坐标表示的是______ 的质量分数;当合金熔点最低时,合金中铅与锡的质量比为_______ 。
②保险丝由铋、铅、锡、镉组成,其熔点约为______ 。
A.15~30℃ B.60~80℃ C.235~250℃ D.300~320℃
(4)北宋沈括在《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾 (硫酸铜晶体)。熬胆矾铁釜,久之亦化为铜”。下列叙述正确的是 。(填序号)
(二)实验室探究铜的冶炼
已知:H2+CuO Cu+H2O。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液。某兴趣小组对此开展如下探究。已知氧化钙为干燥剂,可以吸收除去某些气体中的水蒸气。
Cu+H2O。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液。某兴趣小组对此开展如下探究。已知氧化钙为干燥剂,可以吸收除去某些气体中的水蒸气。

Ⅰ.设计如图1实验装置,开展氢气还原氧化铜实验并检验固体产物。
(5)图1中制取氢气的化学反应方程式为_______ 。
(6)实验开始时, (填序号)
(7)取反应后的红色固体于烧杯中,加入氨水并搅拌,观察到______ ,证明固体产物有Cu2O。
Ⅱ.探究反应生成Cu2O的变化情况。
称取若干份质量均为0.6000g的CuO,在相同条件下分别用氢气还原不同时间(t),检测所得固体中Cu2O的质量(m),结果如图2。
(8)由图2可知,在氢气还原氧化铜反应过程中,Cu2O质量的变化趋势是______ 。
(9)为确保氢气还原氧化铜所得固体产物不含Cu2O,应采取的措施是______ 。
Ⅲ.探究反应生成Cu2O的原因。
为解释实验结果,兴趣小组对氢气还原氧化铜的反应过程提出如下假设:
假设1:经历2CuO+H2 Cu2O+H2O,H2+Cu2O
Cu2O+H2O,H2+Cu2O 2Cu+H2O两个反应,且在同一条件下两个反应同时进行。
2Cu+H2O两个反应,且在同一条件下两个反应同时进行。
假设2:依次经历CuO+H2 Cu+H2O、Cu+CuO
Cu+H2O、Cu+CuO Cu2O、H2+Cu2O
Cu2O、H2+Cu2O 2Cu+H2O三个反应。
2Cu+H2O三个反应。
(10)结合探究Ⅱ的结果,通过计算分析,假设1中“在同一条件下两个反应能同时进行”合理的依据是_______ 。(写出计算过程)
(一)请根据题目回答下列问题。
(1)铝、铁、铜是我们生产生活中使用比较广泛的金属.如图1所示用品中, 主要利用金属延展性的是

(2)铜也容易生锈,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3),是铜与空气中的氧气、水和
(3)合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质.一般来说合金的熔点低于任何一种组成金属的熔点.下表是一些金属的熔点数据。
| 金属 | 铜 | 锌 | 锡 | 铅 | 铋 | 镉 |
| 熔点/℃ | 1083 | 419.6 | 231.9 | 327.5 | 271.3 | 320.9 |
②保险丝由铋、铅、锡、镉组成,其熔点约为
A.15~30℃ B.60~80℃ C.235~250℃ D.300~320℃
(4)北宋沈括在《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾 (硫酸铜晶体)。熬胆矾铁釜,久之亦化为铜”。下列叙述正确的是 。(填序号)
| A.“苦泉”的成分之一 ——CuSO4 |
| B.“挹其水熬之” ——蒸发水分 |
| C.“熬胆矾铁釜,久之亦化为铜” ——发生置换反应 |
(二)实验室探究铜的冶炼
已知:H2+CuO

Ⅰ.设计如图1实验装置,开展氢气还原氧化铜实验并检验固体产物。
(5)图1中制取氢气的化学反应方程式为
(6)实验开始时, (填序号)
| A.先向长颈漏斗中加稀硫酸后点酒精灯 |
| B.先点燃酒精灯加热后向长颈漏斗中加稀硫酸 |
(7)取反应后的红色固体于烧杯中,加入氨水并搅拌,观察到
Ⅱ.探究反应生成Cu2O的变化情况。
称取若干份质量均为0.6000g的CuO,在相同条件下分别用氢气还原不同时间(t),检测所得固体中Cu2O的质量(m),结果如图2。
(8)由图2可知,在氢气还原氧化铜反应过程中,Cu2O质量的变化趋势是
(9)为确保氢气还原氧化铜所得固体产物不含Cu2O,应采取的措施是
Ⅲ.探究反应生成Cu2O的原因。
为解释实验结果,兴趣小组对氢气还原氧化铜的反应过程提出如下假设:
假设1:经历2CuO+H2
假设2:依次经历CuO+H2
(10)结合探究Ⅱ的结果,通过计算分析,假设1中“在同一条件下两个反应能同时进行”合理的依据是
人类文明与社会进步同金属材料关系密切.
(一)金属的广泛应用
(1)钢铁材料通常分为生铁和钢,这两种铁合金的主要区别就在于_________ ,写出成语“百炼成钢”中发生反应的化学方程式_________ .
(2)高铁酸钾是新型净水剂,化学原理是:4K2FeO4+10H2O=4X+3O2+8KOH,X的化学式是_________ .
(二)金属的锈蚀及防护
(1)下列情况下铁制品最易生锈的是_________ (填序号).
a. 潮湿空气中 b. 干燥空气中 c. 部分浸入食盐水中
(2)铁生锈中存在下列转化:Fe(OH)2 Fe(OH)3,该反应的化学方程式为
Fe(OH)3,该反应的化学方程式为_________ .
(三)铁锈组成分析测定
(1)铁锈中一定含Fe2O3•nH2O,可能含FeCO3(FeCO3和稀盐酸的反应与CaCO3相似)),在某铁锈样品中加稀盐酸,_________ (填现象),证明不含FeCO3.
(2)另取23.2g只含Fe2O3•nH2O的上述铁锈样品,按下图装置实验.
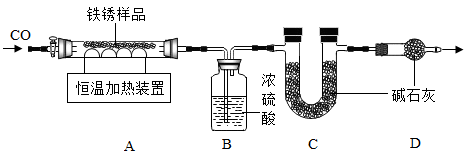
【查阅资料】
①浓硫酸具有吸水性,碱石灰能吸收水和二氧化碳气体.
②在110℃时,Fe2O3•nH2O完全分解为Fe2O3和H2O.
③500℃时Fe2O3才开始被还原,且温度不同时产物可能是Fe3O4、FeO(黑色)、Fe.
(3)向装置中加入铁锈样品前,须进行的操作是________ .
(4)实验时,先通入CO的目的是_________ .
(5)当加热超过500℃时,观察到A中的现象是_________ .
(6)下表为加热至700℃时所测数据,下图为A中固体质量和加热温度关系图
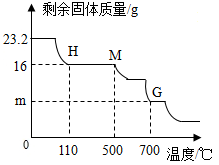
回答下列问题
①Fe2O3•nH2O中n的值为_________ ,图中m的值为_________ .
②若无装置D,则所测n的值_________ (填“偏大”、“偏小”或“不变”)
③700℃以上时,管内固体产物的化学式为_________ ;
④该装置有一明显缺陷,如何改进_________ 。
(一)金属的广泛应用
(1)钢铁材料通常分为生铁和钢,这两种铁合金的主要区别就在于
(2)高铁酸钾是新型净水剂,化学原理是:4K2FeO4+10H2O=4X+3O2+8KOH,X的化学式是
(二)金属的锈蚀及防护
(1)下列情况下铁制品最易生锈的是
a. 潮湿空气中 b. 干燥空气中 c. 部分浸入食盐水中
(2)铁生锈中存在下列转化:Fe(OH)2
(三)铁锈组成分析测定
(1)铁锈中一定含Fe2O3•nH2O,可能含FeCO3(FeCO3和稀盐酸的反应与CaCO3相似)),在某铁锈样品中加稀盐酸,
(2)另取23.2g只含Fe2O3•nH2O的上述铁锈样品,按下图装置实验.

【查阅资料】
①浓硫酸具有吸水性,碱石灰能吸收水和二氧化碳气体.
②在110℃时,Fe2O3•nH2O完全分解为Fe2O3和H2O.
③500℃时Fe2O3才开始被还原,且温度不同时产物可能是Fe3O4、FeO(黑色)、Fe.
(3)向装置中加入铁锈样品前,须进行的操作是
(4)实验时,先通入CO的目的是
(5)当加热超过500℃时,观察到A中的现象是
(6)下表为加热至700℃时所测数据,下图为A中固体质量和加热温度关系图
| 反应前 | 反应后 | |
| 装置B/g | 100.0 | 107.2 |
| 装置C/g | 80.0 | 84.4 |

回答下列问题
①Fe2O3•nH2O中n的值为
②若无装置D,则所测n的值
③700℃以上时,管内固体产物的化学式为
④该装置有一明显缺陷,如何改进
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网




