科学探究题 适中0.65 引用1 组卷50
空气中氧气含量测定再认识。
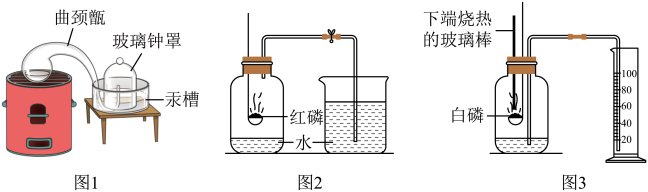
【你知道吗】通过实验(图1)测定了空气组成的科学家是_____ 。
A 门捷列夫 B 达尔文 C 拉瓦锡 D 牛顿
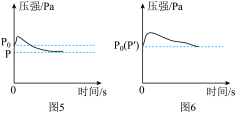
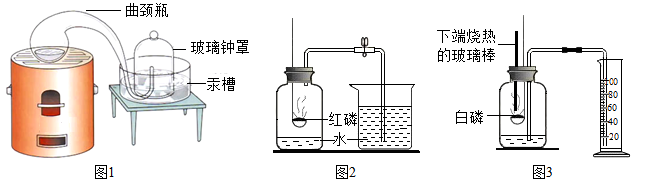
【实验回顾】实验室常用图2所示的方法测定空气中氧气的含量,写出红磷燃烧的文字表达式_____ 。为保证测定结果实验中所取红磷必须_____ 。同学们发现利用图2装置进行实验时,在集气瓶外点燃红磷,一方面会造成空气污染,另一方面伸进集气瓶速度慢了会影响测定结果。他们查阅资料发现白磷40℃即可燃烧,燃烧产物与红磷相同,于是改进装置(图3)重新探究。
【实验探究】先在容积为200.0mL的集气瓶里装进50.0mL的水,再在量筒内装入100.0 mL的水,然后按图连好仪器,按下热的玻璃棒,白磷立即被点燃。
(1)集气瓶里预先装进的水,在实验过程中除了能够加快集气瓶冷却,还起到的作用:____ 。(写出一种即可)
(2)如果白磷停止燃烧时立即记录量筒内剩余水的体积,则会导致测定结果_____ (填“偏大”、“偏小”或“不变”)。
(3)如果实验结束时量筒内剩余水的体积是73.0 mL,则测得的空气中氧气体积分数为_____ 。(用百分数表示)
【拓展延伸】图4所示装置可用于测定空气中氧气的含量,其中与集气瓶相连的压强传感器等电子设备能将集气瓶内气体压强精确地记录并保存下来。图5、图6是用该装置测得的红磷和木炭分别在集气瓶中燃烧的压强-时间关系图(该装置气密性良好,p0是集气瓶内初始气压,p和p′分别是反应结束后恢复到室温时集气瓶内的气压)。
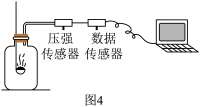
(1)写出木炭燃烧的文字表达式______ 。该实验中能否利用木炭燃烧测定空气中氧气含量,并说明理由:______ 。
(2)图5中反应开始时集气瓶中压强瞬间变大的原因是_____ 。
【交流反思】小明提出能否用铁丝代替上述实验中的红磷测定空气中氧气含量,同学们一致反对,理由是铁丝在空气中不能燃烧。写出铁丝在氧气中燃烧的文字表达式______ 。

【你知道吗】通过实验(图1)测定了空气组成的科学家是
A 门捷列夫 B 达尔文 C 拉瓦锡 D 牛顿
【实验回顾】实验室常用图2所示的方法测定空气中氧气的含量,写出红磷燃烧的文字表达式
【实验探究】先在容积为200.0mL的集气瓶里装进50.0mL的水,再在量筒内装入100.0 mL的水,然后按图连好仪器,按下热的玻璃棒,白磷立即被点燃。
(1)集气瓶里预先装进的水,在实验过程中除了能够加快集气瓶冷却,还起到的作用:
(2)如果白磷停止燃烧时立即记录量筒内剩余水的体积,则会导致测定结果
(3)如果实验结束时量筒内剩余水的体积是73.0 mL,则测得的空气中氧气体积分数为
【拓展延伸】图4所示装置可用于测定空气中氧气的含量,其中与集气瓶相连的压强传感器等电子设备能将集气瓶内气体压强精确地记录并保存下来。图5、图6是用该装置测得的红磷和木炭分别在集气瓶中燃烧的压强-时间关系图(该装置气密性良好,p0是集气瓶内初始气压,p和p′分别是反应结束后恢复到室温时集气瓶内的气压)。


(1)写出木炭燃烧的文字表达式
(2)图5中反应开始时集气瓶中压强瞬间变大的原因是
【交流反思】小明提出能否用铁丝代替上述实验中的红磷测定空气中氧气含量,同学们一致反对,理由是铁丝在空气中不能燃烧。写出铁丝在氧气中燃烧的文字表达式
20-21九年级上·安徽合肥·阶段练习
类题推荐
拉瓦锡被称为“现代化学之父”,让我们共同跟随他的足迹进行科学探究。

【经典实验回顾】
(1)二百多年前,法国化学家拉瓦锡利用图1装置进行实验,发现有一部分银白色的液态汞变成红色粉末,将红色粉末收集起来,放在另一个较小的容器里再加强热,得到了汞和氧气,结果生成的氧气体积_______ (选填“>”、“=”、“<”)密闭容器里减少的体积,将得到的氧气导回密闭容器,所得气体和空气性质完全相同。他得出结论:空气由氧气和氮气组成,其中氧气约占空气总体积 。
。
(2)根据图2资料卡片,选用汞的优点中不可能是_______(填序号)。
【教材实验重温】
(3)实验室常用红磷燃烧法测定空气里氧气的含量(图3),红磷燃烧产生黄色火焰,及现象:_______ ,化学方程式为_______ 。红磷燃烧消耗氧气,产生压强差,消耗气体的体积=_______ 。但是用该方法测出的氧气含量常常远低于21%。
查阅资料:燃烧过程中,当氧气体积分数低于8%左右时,红磷就无法继续燃烧。因此,实验测定结果小于理论值。
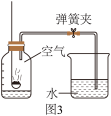
【实验探究改进】化学小组按照图4装置来测定空气里氧气含量,滤纸包中为潮湿的铁粉、少量氯化钠和活性炭(可加快反应速率)。

(4)实验前需检查装置的_______ 。
(5)根据本次实验数据,计算出氧气约占空气总体积的_______ (结果精确到0.1%)。
【反思评价】
(6)①测定空气里氧气的含量实验,通过燃烧消耗氧气测定结果误差较大,通过缓慢氧化消耗氧气测定结果误差较小。
②该实验_______ (选填“能”或“不能”)证明铁锈蚀的条件是与水和空气充分接触。
【表达交流】
(7)18世纪末,拉瓦锡基于“测定空气里氧气的含量实验”的研究思路和定量分析方法,在普利斯特里、卡文迪许两位科学家研究基础上,补充了一个相反的实验:让水蒸气通过一根烧红的枪管,得到,“易燃空气”。通过分析和归纳,他得出结论:水不是一种元素,是由_______ 组成。
(8)拉瓦锡倡导并改进定量分析方法,实验研究了氧化汞的分解和合成反应中各物质_______ 之间的变化关系,验证了质量守恒定律。在科学探索道路上,拉瓦锡这种严谨的科学精神值得我们学习。

【经典实验回顾】
(1)二百多年前,法国化学家拉瓦锡利用图1装置进行实验,发现有一部分银白色的液态汞变成红色粉末,将红色粉末收集起来,放在另一个较小的容器里再加强热,得到了汞和氧气,结果生成的氧气体积
(2)根据图2资料卡片,选用汞的优点中不可能是_______(填序号)。
| A.在汞槽中起到液封作用 |
| B.汞蒸气与氧气反应能将密闭容器空气中的氧气几乎耗尽 |
| C.实验过程中没有污染 |
| D.生成的化合物加热分解又能得到汞和氧气 |
【教材实验重温】
(3)实验室常用红磷燃烧法测定空气里氧气的含量(图3),红磷燃烧产生黄色火焰,及现象:

查阅资料:燃烧过程中,当氧气体积分数低于8%左右时,红磷就无法继续燃烧。因此,实验测定结果小于理论值。
【实验探究改进】化学小组按照图4装置来测定空气里氧气含量,滤纸包中为潮湿的铁粉、少量氯化钠和活性炭(可加快反应速率)。

| 实验前 | 实验后 | |
| 集气瓶(扣除滤纸包)和导管容积 | 量筒中水的体积 | 量筒中水的体积 |
| 131mL | 90.0mL | 63.7mL |
(4)实验前需检查装置的
(5)根据本次实验数据,计算出氧气约占空气总体积的
【反思评价】
(6)①测定空气里氧气的含量实验,通过燃烧消耗氧气测定结果误差较大,通过缓慢氧化消耗氧气测定结果误差较小。
②该实验
【表达交流】
(7)18世纪末,拉瓦锡基于“测定空气里氧气的含量实验”的研究思路和定量分析方法,在普利斯特里、卡文迪许两位科学家研究基础上,补充了一个相反的实验:让水蒸气通过一根烧红的枪管,得到,“易燃空气”。通过分析和归纳,他得出结论:水不是一种元素,是由
(8)拉瓦锡倡导并改进定量分析方法,实验研究了氧化汞的分解和合成反应中各物质
小明通过阅读《科学的历程》知道质量守恒定律的发现经历了漫长、曲折的过程。
历程与思考
历程一:早在1663年,英国化学家波义耳将金属汞放在密闭容器里煅烧,打开容器盖冷却后称量,得出的结论是物质的总质量增加了,导致波义耳与质量守恒定律失之交臂你认为质量增大的原因是_____ 。
历程二:1756年,俄国化学家罗蒙诺索素夫将金属锡放在密闭容器里煅烧,发现总质量和煅烧前没有变化。
历程三:1774年,拉瓦锡将45.0份质量的氧化汞加热分解,恰好得到了41.5份质量的汞和3.5份质量的氧气,得到了与罗蒙诺索夫相同的结论,从而总结出了质量守恒定律。拉瓦锡还通过这个实验研究了_____ ,成就了化学史上的另一经典实验。
验证与拓展
为了验证科学家们发现的质量守恒定律,小明设计了如图所示的三个实验,
【实验步骤】
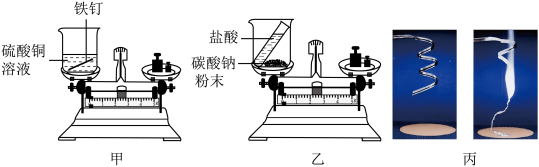
如图所示,甲、乙实验,用砝码使天平平衡后,随即使其发生反应,丙实验对石棉网和打磨干净的镁条进行反应前后的称量。三组实验小明都进行了规范的操作以及准确的称量和认真观察。请完成下表内容。
【实验分析】通过对上述实验的对比分析,小明认为实验甲遵守质量守恒定律,而实验乙和丙不遵守质量守恒。小组同学认为小明这种说法不正确,请分析导致实验乙和丙反应前后称量质量不相等的原因_____ 。
【实验结论】化学反应都遵守质量守恒定律。
请从微观的角度分析化学反应遵循质量守恒的原因是_____ 。
【实验拓展】小明查阅资料发现,实验甲得到的铜在工业上能与氯化铜溶液和盐酸在50℃时反应制作电路,生成物经处理又能转化为氯化铜。反应如下:
① ;②
;② ;③
;③
(1)反应②中X的化学式为_____ 。
(2)反应①中氯化铜的质量_____ (填“=”或“<”或“>”)反应③中氯化铜的质量。
(3)反应①结束后,进行蒸发操作得到固体的质量为10.66g,其中铜元素的质量为6.4g该固体的成分为_____ 。
历程与思考
历程一:早在1663年,英国化学家波义耳将金属汞放在密闭容器里煅烧,打开容器盖冷却后称量,得出的结论是物质的总质量增加了,导致波义耳与质量守恒定律失之交臂你认为质量增大的原因是
历程二:1756年,俄国化学家罗蒙诺索素夫将金属锡放在密闭容器里煅烧,发现总质量和煅烧前没有变化。
历程三:1774年,拉瓦锡将45.0份质量的氧化汞加热分解,恰好得到了41.5份质量的汞和3.5份质量的氧气,得到了与罗蒙诺索夫相同的结论,从而总结出了质量守恒定律。拉瓦锡还通过这个实验研究了
验证与拓展
为了验证科学家们发现的质量守恒定律,小明设计了如图所示的三个实验,
【实验步骤】

如图所示,甲、乙实验,用砝码使天平平衡后,随即使其发生反应,丙实验对石棉网和打磨干净的镁条进行反应前后的称量。三组实验小明都进行了规范的操作以及准确的称量和认真观察。请完成下表内容。
| 实验 | 实验现象 | 反应化学方程式 |
| 甲 | ||
| 乙 | ||
| 丙 |
【实验分析】通过对上述实验的对比分析,小明认为实验甲遵守质量守恒定律,而实验乙和丙不遵守质量守恒。小组同学认为小明这种说法不正确,请分析导致实验乙和丙反应前后称量质量不相等的原因
【实验结论】化学反应都遵守质量守恒定律。
请从微观的角度分析化学反应遵循质量守恒的原因是
【实验拓展】小明查阅资料发现,实验甲得到的铜在工业上能与氯化铜溶液和盐酸在50℃时反应制作电路,生成物经处理又能转化为氯化铜。反应如下:
①
(1)反应②中X的化学式为
(2)反应①中氯化铜的质量
(3)反应①结束后,进行蒸发操作得到固体的质量为10.66g,其中铜元素的质量为6.4g该固体的成分为
空气中氧气含量测定再认识。
【你知道吗】
(1)通过实验(图1)测定了空气组成的科学家是__________(填字母)
【实验回顾】
(2)实验室常用图2所示装置测定空气中氧气的含量,红磷燃烧的符号表达式为__________ 。
为保证测定结果,实验中所取红磷的用量必须__________ 。同学们发现利用图2装置进行实验时,在集气瓶外点燃红磷,一方面会造成空气污染,另一方面伸进集气瓶速度慢了会影响测定结果。他们查阅资料发现白磷40℃即可燃烧。燃烧产物与红磷相同,于是改进装置(图3)重新探究。
【实验探究】先在容积为200.0mL的集气瓶里装进50.0mL的水,再在量筒内装入100.0mL的水,然后按图连好仪器,按下热的玻璃棒,白磷立即被点燃
(3)集气瓶里预先装进的水,在实验过程中除了能够吸热和吸收有毒物质,还起到的作用:__________ 。
(4)若白磷停止燃烧时立即记录量筒内剩余水的体积,则会导致测定结果__________ (填“偏大”、“偏小”或“不变”)
(5)若实验结束时量筒内剩余水的体积是73.0mL,则测得的空气中氧气体积分数为__________ 。(用百分数表示)

【你知道吗】
(1)通过实验(图1)测定了空气组成的科学家是__________(填字母)
| A.门捷列夫 | B.达尔文 | C.拉瓦锡 | D.牛顿 |
【实验回顾】
(2)实验室常用图2所示装置测定空气中氧气的含量,红磷燃烧的符号表达式为
为保证测定结果,实验中所取红磷的用量必须
【实验探究】先在容积为200.0mL的集气瓶里装进50.0mL的水,再在量筒内装入100.0mL的水,然后按图连好仪器,按下热的玻璃棒,白磷立即被点燃
(3)集气瓶里预先装进的水,在实验过程中除了能够吸热和吸收有毒物质,还起到的作用:
(4)若白磷停止燃烧时立即记录量筒内剩余水的体积,则会导致测定结果
(5)若实验结束时量筒内剩余水的体积是73.0mL,则测得的空气中氧气体积分数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


