科学探究题 0.65 引用1 组卷48
某化学兴趣小组的同学了解到用亚硫酸钠溶液与浓硫酸反应可制备一定量的SO2。老师给他们提供了一瓶亚硫酸钠溶液,并告知该瓶溶液放置时间可能较长,不知是否变质。兴趣小组的同学于是分成了甲、乙两小组,对该瓶亚硫酸钠溶液的成分等问题进行实验探究。
【提出问题】(1)该瓶溶液中溶质的成分是什么?
(2)该瓶溶液中亚硫酸钠的质量分数是多少?
【查阅资料】(1)
(2)Na2SO3能与酸反应产生SO2气体
(3)Na2SO3有较强还原性在空气中易被氧气氧化: 。
。
(4)SO 、SO
、SO 均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
【做出猜想】猜想1:成分是Na2SO3
猜想2:成分是Na2SO4
猜想3:成分是_________ 。
【实验探究Ⅰ】甲、乙两组分别进行实验探究溶液是否变质。
【方案评价】(1)有同学质疑甲组方案不合理,理由是______ 。
(2)乙组同学加入过量氯化钡溶液的作用是_________ 。
【实验探究Ⅱ】两组同学设计如下图实验测定Na2SO3溶液的溶质质量分数。(注:空气中二氧化碳的影响忽略不计)。
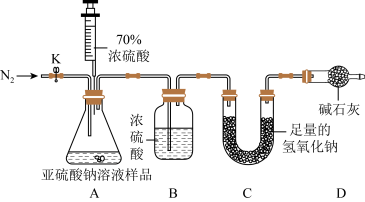
实验步骤:(1)连好装置并检查装置气密性,在锥形瓶中放入100g该样品;
(2)实验前称量C装置的质量;
(3)关闭活塞K,用注射器推入浓硫酸至不再产生气泡;
(4)打开活塞K,缓缓鼓入一定量的氮气,关闭活塞K;
(5)再次称量C装置的质量发现比反应前增重3.2g。
由此,计算出该溶液中Na2SO3的质量分数为________ 。装置C中发生反应的化学方程式为_______ 。
【反思评价】若没有进行第4步操作,则测得亚硫酸钠溶液的溶质质量分数比实际值_______ (填“偏小”或“偏大”)。
【提出问题】(1)该瓶溶液中溶质的成分是什么?
(2)该瓶溶液中亚硫酸钠的质量分数是多少?
【查阅资料】(1)
(2)Na2SO3能与酸反应产生SO2气体
(3)Na2SO3有较强还原性在空气中易被氧气氧化:
(4)SO
【做出猜想】猜想1:成分是Na2SO3
猜想2:成分是Na2SO4
猜想3:成分是
【实验探究Ⅰ】甲、乙两组分别进行实验探究溶液是否变质。
| 小组 | 实验操作 | 现象 | 结论 |
| 甲组 | 取少量样品于试管中,加入过量稀盐酸 | 产生气泡 | 没有变质,还是Na2SO3 |
| 乙组 | 取少量样品于试管中,加入过量氯化钡溶液,再加入足量稀盐酸 | 产生白色沉淀, | 已部分变质 |
(2)乙组同学加入过量氯化钡溶液的作用是
【实验探究Ⅱ】两组同学设计如下图实验测定Na2SO3溶液的溶质质量分数。(注:空气中二氧化碳的影响忽略不计)。

实验步骤:(1)连好装置并检查装置气密性,在锥形瓶中放入100g该样品;
(2)实验前称量C装置的质量;
(3)关闭活塞K,用注射器推入浓硫酸至不再产生气泡;
(4)打开活塞K,缓缓鼓入一定量的氮气,关闭活塞K;
(5)再次称量C装置的质量发现比反应前增重3.2g。
由此,计算出该溶液中Na2SO3的质量分数为
【反思评价】若没有进行第4步操作,则测得亚硫酸钠溶液的溶质质量分数比实际值
2019·广西·三模


