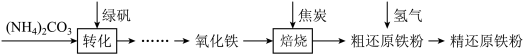
科学探究题 困难0.15 引用6 组卷934
【查阅资料】①碱石灰可用于吸收CO2、水蒸气
②含有Fe2+的盐溶液可与
③含有Fe3+的盐溶液可与KSCN发生反应生成红色溶液
【提出问题】样品完全分解后,除水蒸气外还生成哪些产物?
【猜想与假设】猜想一:气体产物中含有CO
猜想二:气体产物中含有CO2
猜想三:气体产物中含有
【实验探究】
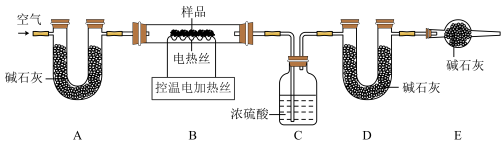
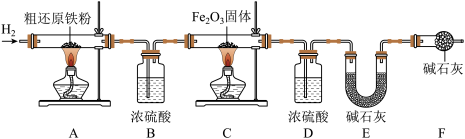
(1)探究气体产物。
小李同学对气体产物进行探究,设计如下实验(夹持装置及部分装置省略):
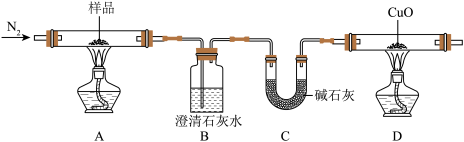
(2)探究固体产物。
小赵同学对固体产物进行如下探究:取
| 实验 | 现象 | 结论 | |
| 取滤液加入硫酸 | 固体中含有K2CO3 | ||
| 取滤渣加入硫酸溶解后,分成两份 | 一份中加入 | 固体中含有FeO | |
| 另一份中加入KSCN | 溶液变为红色 | 固体中含有 | |
【实验结论】
【拓展延伸】晒制蓝图时,用
432gFeC2O4在一定条件下分解可以得到一种具有磁性的黑色固体和两种含有相同元素的气体,则两种气体质量的最简整数比为
2020·云南昆明·中考真题
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网