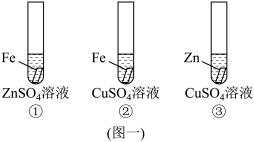
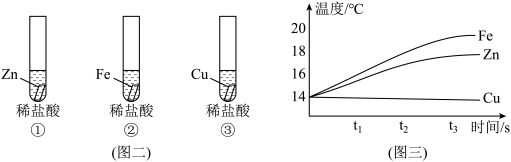
科学探究题 适中0.65 引用1 组卷46
某校课外兴趣小组同学对有关镁与盐酸反应的系列研究:
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)实验时需将镁条进行打磨,其目的是_____ 。
(2)反应中试管外壁发烫,说明镁与稀盐酸反应是_____ 反应,化学方程式为 _____ 。
(3)实验 测得镁片产生气体的速率(v)与时间(t)的关系如图所示,则 t1~t2 时间 内反应速率逐渐加快的主要原因是_____ 。
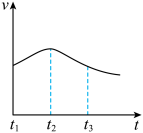
研究二:探究反应后所得溶液的酸碱性
【发现问题]
(1)反应后甲同学用 pH 试纸测定试管中溶液的酸碱性,发现 pH 小于 7。
(2)反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,振荡显红色, 对此现象,乙同学重复如上实验,得到同样结果。
【提出猜想】甲同学:猜想Ⅰ:稀盐酸过量,使溶液 pH 小于 7;
猜想Ⅱ:氯化镁溶液 pH 小于 7. 乙同学:猜想Ⅰ:氯化镁溶液使酚酞变红色;
猜想Ⅱ:镁与热水反应使酚酞溶液变红色。
【实践与思考】为验证猜想,甲、乙两同学均需进行一个探究实验是_____ . 乙同学为完成猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很 快变为红色,同时还观察到镁条表面有气体生成.该气体能燃烧。请你根据实验现象写 出镁与水反应的化学反应方程式 _____ 。
【结论】(1)镁与稀盐酸反应,镁反应完全后所得溶液显酸性;
(2)镁与稀盐酸反应,镁过量时所得溶液显碱性。
【交流与反思】氯化钠溶液呈中性,而上述甲同学实验中镁完全反应后所得溶液显酸 性,你认为与溶液中_____ (填离子符号)。
一段时间后,乙同学观察到溶液红色逐渐变淡,最后消失,你认为原因可能是_____ 请设计实验验证你的猜想 _____ 。
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)实验时需将镁条进行打磨,其目的是
(2)反应中试管外壁发烫,说明镁与稀盐酸反应是
(3)实验 测得镁片产生气体的速率(v)与时间(t)的关系如图所示,则 t1~t2 时间 内反应速率逐渐加快的主要原因是

研究二:探究反应后所得溶液的酸碱性
【发现问题]
(1)反应后甲同学用 pH 试纸测定试管中溶液的酸碱性,发现 pH 小于 7。
(2)反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,振荡显红色, 对此现象,乙同学重复如上实验,得到同样结果。
【提出猜想】甲同学:猜想Ⅰ:稀盐酸过量,使溶液 pH 小于 7;
猜想Ⅱ:氯化镁溶液 pH 小于 7. 乙同学:猜想Ⅰ:氯化镁溶液使酚酞变红色;
猜想Ⅱ:镁与热水反应使酚酞溶液变红色。
【实践与思考】为验证猜想,甲、乙两同学均需进行一个探究实验是
【结论】(1)镁与稀盐酸反应,镁反应完全后所得溶液显酸性;
(2)镁与稀盐酸反应,镁过量时所得溶液显碱性。
【交流与反思】氯化钠溶液呈中性,而上述甲同学实验中镁完全反应后所得溶液显酸 性,你认为与溶液中
一段时间后,乙同学观察到溶液红色逐渐变淡,最后消失,你认为原因可能是
19-20九年级下·安徽宿州·阶段练习
类题推荐
为验证金属的活动性顺序,我校化学兴趣小组的同学将打磨过的铝片放入15%的氯化铜溶液中,观察有红色固体生成,且铝片表面产生大量无色气泡,放出大量的热,一段时间后生成了一种白色不溶物。小组同学对观察到的现象特别好奇,请你与小组同学一起探究。
(1)实验前打磨铝片的原因是_______ 。
(2)生成红色物质的化学方程式为_______ 。
(3)已知氯化铜溶液呈酸性,结合金属的化学性质分析,铝片表面产生的大量无色气体可能是_______ (填名称)。
【提出问题】白色沉淀的化学成分是什么?
【查阅资料】
①铝不溶于乙醇;
②AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇;
③CuCl为白色固体,不溶于水、乙醇,溶于浓盐酸且溶液变为褐色。
【猜想假设】
猜想1:该白色不溶物可能是Al
猜想2:该白色不溶物可能是AlCl3
猜想3:该白色不溶物可能是CuCl
【实验方案】
(4)取白色不溶物分别进行如下实验:
【反思评价】
(5)白色不溶物是Cu与CuCl2溶液反应生成的,该反应的化学方程式为_______ 。
(1)实验前打磨铝片的原因是
(2)生成红色物质的化学方程式为
(3)已知氯化铜溶液呈酸性,结合金属的化学性质分析,铝片表面产生的大量无色气体可能是
【提出问题】白色沉淀的化学成分是什么?
【查阅资料】
①铝不溶于乙醇;
②AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇;
③CuCl为白色固体,不溶于水、乙醇,溶于浓盐酸且溶液变为褐色。
【猜想假设】
猜想1:该白色不溶物可能是Al
猜想2:该白色不溶物可能是AlCl3
猜想3:该白色不溶物可能是CuCl
【实验方案】
(4)取白色不溶物分别进行如下实验:
| 实验编号 | 实验操作 | 实验现象 | 实验结论 |
| I | 加入足量无水乙醇 | 固体不溶解 | 猜想2 |
| II | 加入适量浓盐酸 | 猜想1不成立,猜想3成立 |
【反思评价】
(5)白色不溶物是Cu与CuCl2溶液反应生成的,该反应的化学方程式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网