解答题-原理综合题 适中0.65 引用2 组卷222
甲烷水蒸气重整和水气变换是传统的制氢方法,反应如下 :
①CH4(g)+H2O(g)⇌CO(g)+3H2 (g) △H1= 206kJ•mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) △H2= - 4 1 kJ•mol-1
近期报道,用二氧化碳作为氧化剂和甲烷重整制氢的新反应路线如下,可生成适宜 H2/ CO 的合成气。
③CH4 (g)+CO2 (g)⇌2CO(g)+2H2(g) △H3
(1)下列措施最有利于提高反应③CH4的平衡转化率条件是______________ 。
A. 升高温度,同时对原料气进行加压 B. 降低温度,同时对原料气进行加压
C. 升高温度,同时用氩气稀释原料气 D. 降低温度,同时用氩气稀释原料气
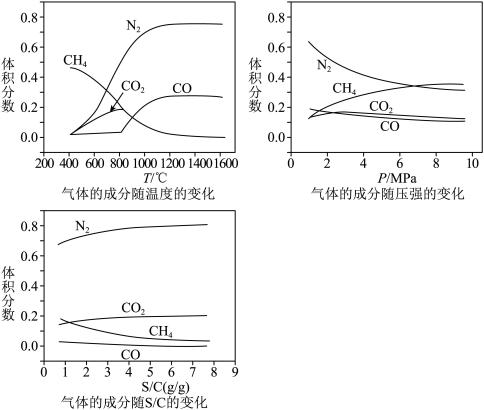
(2)重整反应器中以上三个反应都在发生,不同反应条件下达到平衡时的进程如下:

I.根据图1,在_________ ( 填写反应条件)时CO2的转化率为负值,主要原因:一是 CO2稳定性较高,低浓度时难以和甲烷反应;二是 ___________ 。
II.根据图,2随着反应温度和反应物中 的提高,体系中反应
的提高,体系中反应____ 填①、②、③)逐渐占据主导。若 850℃、 为0.5时重整反应器中达到平衡时,体系中CO2和水蒸气浓度相等,求此条件下反应②的平衡常数K=
为0.5时重整反应器中达到平衡时,体系中CO2和水蒸气浓度相等,求此条件下反应②的平衡常数K=__ 。
(3)固体氧化物电解池(传导O2-)将CO2和H2O 转化为n(H2):n(CO)=1的合成气并联产高纯度O2,写出电解池阴极反应式__________________ 。
①CH4(g)+H2O(g)⇌CO(g)+3H2 (g) △H1= 206kJ•mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) △H2= - 4 1 kJ•mol-1
近期报道,用二氧化碳作为氧化剂和甲烷重整制氢的新反应路线如下,可生成适宜 H2/ CO 的合成气。
③CH4 (g)+CO2 (g)⇌2CO(g)+2H2(g) △H3
(1)下列措施最有利于提高反应③CH4的平衡转化率条件是
A. 升高温度,同时对原料气进行加压 B. 降低温度,同时对原料气进行加压
C. 升高温度,同时用氩气稀释原料气 D. 降低温度,同时用氩气稀释原料气
(2)重整反应器中以上三个反应都在发生,不同反应条件下达到平衡时的进程如下:

I.根据图1,在
II.根据图,2随着反应温度和反应物中
(3)固体氧化物电解池(传导O2-)将CO2和H2O 转化为n(H2):n(CO)=1的合成气并联产高纯度O2,写出电解池阴极反应式
19-20高三下·浙江·开学考试
类题推荐
天然气水蒸气重整法是工业上生产氢气的重要方法,反应在 400℃以上进行。l 00kPa 时,在反应容器中通入甲烷与为水蒸气体积比为1 : 5的混合气体,发生下表反应。
请回答下列下列问题:
(1)上表中数据 a=__________ ; b= ___________ 。
(2)对于反应②,既能加快反应又能提高CH4转化率的措施是_____________ 。
A.升温 B.加催化剂 C.加压 D.吸收CO2
(3)下列情况能说明容器中各反应均达到平衡的是___________ 。
A.体系中H2O与CH4物质的量之比不再变化
B.体系中H2的体积分数保持不变
C.生成n 个CO2的同时消耗2n个H2O
D. v正(CO)= v逆(H2)
(4)工业重整制氢中,因副反应产生碳会影响催化效率,需要避免温度过高以减少积碳。该体系中产生碳的反应方程式为_______________ 。
(5)平衡时升温,CO含量将_________ (选填“增大”或“减小”)。
(6)一定温度下 ,平衡时测得体系中 CO2和H2的物质的量浓度分别是0.75mo l/L、4.80mol/L , 则此时体系中CO 物质的量浓度是_______ mol/L。
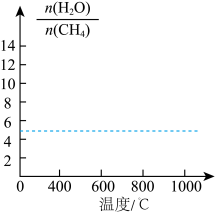
(7)改变上述平衡体系的温度,平衡时H2O与CH4物质的量之比[ ]值也会随着改变,在图中画出其变化趋势。
]值也会随着改变,在图中画出其变化趋势。________________
| 反应方程式 | 焓变△H(kJ/mol) | 600℃时的平衡常数 |
①CH4(g)+ H2O(g) CO(g)+3H2(g) CO(g)+3H2(g) | a | 0.6 |
②CH4(g)+ 2H2O(g)  CO2(g)+4H2 (g) CO2(g)+4H2 (g) | +165.0 | b |
③CO(g)+ H2O(g)  CO2(g)+H2 (g) CO2(g)+H2 (g) | -41.2 | 2.2 |
请回答下列下列问题:
(1)上表中数据 a=
(2)对于反应②,既能加快反应又能提高CH4转化率的措施是
A.升温 B.加催化剂 C.加压 D.吸收CO2
(3)下列情况能说明容器中各反应均达到平衡的是
A.体系中H2O与CH4物质的量之比不再变化
B.体系中H2的体积分数保持不变
C.生成n 个CO2的同时消耗2n个H2O
D. v正(CO)= v逆(H2)
(4)工业重整制氢中,因副反应产生碳会影响催化效率,需要避免温度过高以减少积碳。该体系中产生碳的反应方程式为
(5)平衡时升温,CO含量将
(6)一定温度下 ,平衡时测得体系中 CO2和H2的物质的量浓度分别是0.75mo l/L、4.80mol/L , 则此时体系中CO 物质的量浓度是
(7)改变上述平衡体系的温度,平衡时H2O与CH4物质的量之比[

氢气是一种重要的化工原料,可由甲烷水蒸气催化重整的方法制备。CH4与H2O重整主要发生下列反应:
I) CH4(g)+H2O(g)⇌CO(g)+3H2(g) = +206.3kJ·mol-1
= +206.3kJ·mol-1
II) CO(g)+H2O(g)⇌H2(g)+CO2(g) = -41.2kJ·mol-1
= -41.2kJ·mol-1
(1)研究表明,反应II在Fe3O4催化下进行,反应历程如下:
第一步:Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)(慢)
第二步:3Fe(s)+_______ =Fe3O4(s)+4H2(g) (快)  =
=_______ 。
下图中能体现反应II的能量变化的是_______ (填标号)。
A、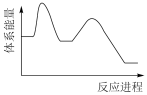 B、
B、
C、 D、
D、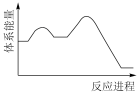
(2)已知CaO(s)+CO2(g)=CaCO3(s) = -178.8kJ·mol-1。向重整反应体系中加入适量多孔CaO的目的是
= -178.8kJ·mol-1。向重整反应体系中加入适量多孔CaO的目的是_______ 。
(3)CH4与H2O重整体系在一定条件下达到平衡后,下列说法不正确的有_______。
(4)一定压强下,将 混合气体通入反应体系。平衡时,各组分的物质的量分数与温度的关系如图所示。
混合气体通入反应体系。平衡时,各组分的物质的量分数与温度的关系如图所示。
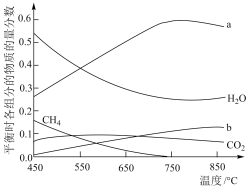
①图中表示H2、CO变化的曲线分别是_______ 、_______ 。
②从平衡的角度分析750℃以后曲线a下降的原因是_______ 。
(5)CH4与CO2重整也可制备H2,反应为:CH4(g)+CO2(g) 2CO(g)+2H2(g)。某温度下,向体积为1L的刚性容器中加入2mol CH4、1mol CO2和催化剂进行重整反应,平衡后H2的物质的量分数为25%,该反应的平衡常数为
2CO(g)+2H2(g)。某温度下,向体积为1L的刚性容器中加入2mol CH4、1mol CO2和催化剂进行重整反应,平衡后H2的物质的量分数为25%,该反应的平衡常数为_______ (保留三位有效数字)。
I) CH4(g)+H2O(g)⇌CO(g)+3H2(g)
II) CO(g)+H2O(g)⇌H2(g)+CO2(g)
(1)研究表明,反应II在Fe3O4催化下进行,反应历程如下:
第一步:Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)(慢)
第二步:3Fe(s)+
下图中能体现反应II的能量变化的是
A、
 B、
B、
C、
 D、
D、
(2)已知CaO(s)+CO2(g)=CaCO3(s)
(3)CH4与H2O重整体系在一定条件下达到平衡后,下列说法不正确的有_______。
| A.升高反应温度,反应I、II的正反应速率都增大 |
| B.换用更高效的催化剂,可提高CH4的平衡转化率 |
| C.增大水蒸气的浓度,反应I、II的正反应速率都增大 |
| D.增大体系压强,反应II的反应速率保持不变,平衡不移动 |

①图中表示H2、CO变化的曲线分别是
②从平衡的角度分析750℃以后曲线a下降的原因是
(5)CH4与CO2重整也可制备H2,反应为:CH4(g)+CO2(g)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网